Химическое равновесие
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного расхода одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях.
Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению:
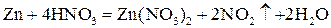
При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении – пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится – данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой – необратимая реакция.
Пример 2. Синтез аммиака протекает согласно уравнению:
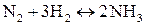
Если смешать один моль азота с тремя молями водорода, осуществить в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Таким образом, синтез аммиака – обратимая реакция. На рисунке 4.3. показано изменение скоростей прямой и обратной реакций с течением времени.
 Рис. 4.3. Изменение скоростей прямой и обратной реакций с течением времени
Рис. 4.3. Изменение скоростей прямой и обратной реакций с течением времени
| Вначале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной реакции равна нулю. Со временем исходные вещества расходуются, в результате этого уменьшается скорость прямой реакции. Одновременно появляются продукты реакции, и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. |
Когда скорости прямой и обратной реакции становится одинаковыми, наступает химическое равновесие. Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза йодоводорода:

Согласно закону действия масс скорости прямой ( 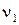 )и обратной(
)и обратной( 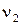 )реакции выражаются уравнениями:
)реакции выражаются уравнениями:
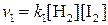 ;
; 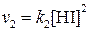
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
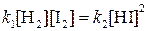
или
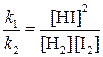
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):

Отсюда окончательно
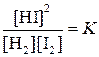
В левой части этого уравнения стоят те концентрации взаимодействующих веществ, которые устанавливаются при равновесии – равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину.
Можно показать, что в общем случае обратимой реакции
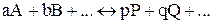
константа равновесия выразится уравнением:
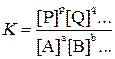
Уравнение константы равновесия показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс, входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции:
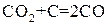
константа имеет вид:
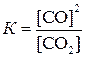
Величина константы равновесия зависит от природы реагирующих веществ и от температуры, но не зависит от присутствия катализаторов.
Константа равновесия связана со стандартным изменением энергии Гиббса уравнением:
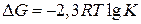
При подстановке значения R = 8,31 Дж/моль ∙ К

При Т = 298 К
 (1)
(1)
Пример. Вычислить константу равновесия реакции
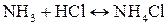
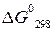 -16,7 -95,4 -203,7
-16,7 -95,4 -203,7
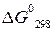 = - 203,7 - (- 16,7 - 95,4) = - 91,6 кДж
= - 203,7 - (- 16,7 - 95,4) = - 91,6 кДж
Найденное значение подставим в уравнение (1):
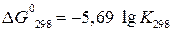
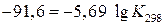
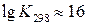

Большое значение К показывает, что при стандартных условиях равновесие данной реакции сильно смещено вправо, т.е. при 25˚С NH4Cl – устойчивое соединение.
Дата добавления: 2020-03-21; просмотров: 521;











