Смещение химического равновесия. Принцип Ле Шателье
Если система находится в состоянии равновесия, то она будит пребывать в нем до тех пор, пока внешние условия сохраняются постоянными.
Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого – либо из веществ, участвующих в равновесии, давления или температуры.
Рассмотрим каждый из этих случаев.
1. При увеличении концентрации какого-либо вещества, участвующего в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо вещества равновесие смещается в сторону образования этого вещества.
Например, для реакции

Введем в систему дополнительно некоторое количество водорода. Согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции – реакции синтеза HI, тогда как скорость обратной реакции не изменится. В прямом направлении реакция будет теперь протекать быстрее, чем в обратном, т.е. равновесие смещается вправо, т.е. в направлении течения прямой реакции. При обратном изменении концентраций говорят о смещении равновесия влево – в направлении обратной реакции.
2. При увеличении давления путем сжатия системы равновесие смещается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
Для реакции

увеличение давления должно смещать равновесие вправо (слева число моль газов равно 3, справа – 2).
В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе

равновесие не нарушается при изменении объема; выход HI не зависит от давления.
3. При повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической реакции.
Так, синтез аммиака представляет собой экзотермическую реакцию (ΔН<0)

Поэтому при повышении температуры равновесие в системе  сдвигается влево – в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты.
сдвигается влево – в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты.
Наоборот, синтез оксида азота (II) представляет собой эндотермическую реакцию (ΔН > 0)

Поэтому при повышении температуры равновесие в системе 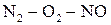 сдвигается вправо в сторону образования NO.
сдвигается вправо в сторону образования NO.
Закономерности, которые проявляются в рассмотренных примерах нарушения химического равновесия, представляют собой частные случаи общего принципа Ле Шателье:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Гетерогенное химическое равновесие также подчиняется принципу Ле Шателье, но твердые исходные вещества и продукты реакции не влияют на смещение гетерогенного химического равновесия.
Дата добавления: 2020-03-21; просмотров: 494;











