ТЕМА 2. ХИМИЧЕСКАЯ СВЯЗЬ
Под химической связью понимают различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и ионных веществ.
К основным чертам химической связи можно отнести:
а) снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована;
б) перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
К основным видам связи относится ионная, ковалентная и металлическая.
В молекулах типичны следующие виды химической связи:
— ковалентная;
— донорно-акцепторная;
— ионная.
При взаимодействии молекул друг с другом возникают химические связи:
— донорно-акцепторная;
— некоторые разновидности ковалентной связи;
— водородная.
В твердом веществе возможны следующие виды химической связи:
— ковалентная (атомные кристаллы);
— ионная;
— металлическая.
Правило октета. В езультате образования химической связи атомы могут приобретать такую же электронную конфигурацию, как у благородных газов, которые (за исключением гелия) имеют на внешней оболочке восемь (октет) электронов. Стремление к созданию такой устойчивой электронной кофигурации получило название правила октета. Это справедливо как для ионной, так и ковалентной связей.
Энергия и длина связи. Количество энергии, выделяющееся при образовании химической связи, называется энергией химической связи Есв. Она имеет единицу измерения кДж/моль. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Например, энергию связи в метане определяют путем деления энергии образования молекулы СН4 из атомов водорода и углерода на четыре (1640 ׃ 4 = 410 кДж/моль). Чем больше энергия химической связи, тем устойчивее молекулы. Например, молекула HF устойчивее молекулы HBr.
Таблица 2.1. Энергия (Есв) и длины (lсв) некоторых химических связей
| Связь | Есв, кДж/моль | lсв, нм | Связь | Есв, кДж/моль | lсв, нм | |
| H-F | 0,092 | H-S | 0,134 | |||
| H-Cl | 0,128 | O=O | 0,121 | |||
| H-Br | 0,142 | N≡N | 0,110 | |||
| H-I | 0,162 | -C≡C- | 0,120 | |||
| C-C | 0,154 | C≡O | 0,113 |
Важной характеристикой химической связи является ее длина lсв, равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул (табл. 2.1.). Например, в ряду галогеноводородов от HF до HI длина связи растет, а ее энергия уменьшается.
Ковалентная связь
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной связью.
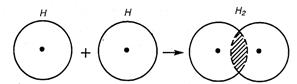
Рассмотрим для примера образование ковалентной связи в молекуле водорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис.2.1.)
|
| Рис. 2.1. Перекрывание электронных облаков при образовании молекулы водорода |
Электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы (рис. 2.2.).
| Однако при очень сильном сближении атомов возрастает отталкивание ядер. Поэтому оптимальное расстояние между ядрами (длина связи lсв), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв. Ковалентная связь обладает насыщаемостью и направленностью. Насыщаемость ковалентной связи вызывается ограничением числа электронов, находящихся на внешних оболочках, которые могут участвовать в образовании ковалентной связи. |  Рис. 2.2. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами. Е – энергия связи
Рис. 2.2. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами. Е – энергия связи
|
Так как атомные орбитали пространственно ориентированы, то перекрывание электронных облаков происходит по определённым направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах и твердых телах.
Полярность ковалентной связи. Если ковалентная связь образована одинаковыми атомами, например 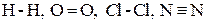 , то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью.
, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью.
В молекулах состоящих из атомов разных элементов, связующее электронное облако оттягивается к тому из них, у которого больше значение электроотицательности. Это полярная ковалентная связь. Разность электроотицательности атомов характеризует полярность связи.
В результате смещения электронной пары первый атом приобретает избыточный отрицательный заряд, а второй избыточный отрицательный заряд. Эти заряды называются эффективными зарядами атомов в молекуле δ- и δ+. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя µсв, равный произведению эффективного заряда σ на длину диполя lд
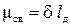
Электрический момент диполя имеет единицу измерения кулон на метр (Кл · м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3 · 10-30 Кл · м (табл. 2.1.).
Как видно и табл. 2.2, электрический момент диполя растет с увеличением разности ЭО.
Таблица 2.2. Электрический момент диполя химической связи в молекулах
| Связь | Разность ЭО | µсв, D | Связь | Разность ЭО | µсв, D | |
| H-F | 1,9 | 1,98 | H-O | 1,4 | 1,53 | |
| H-Cl | 0,7 | 1,03 | H-N | 0,9 | 1,3 | |
| H-Br | 0,74 | 0,78 | H-S | 0,4 | 0,7 | |
| H-I | 0,4 | 0,38 | H-C | 0,4 | 0,3 |
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Сигма-связь. Как уже говорилось, ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями атомных орбиталей (АО) в пространстве. Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью.
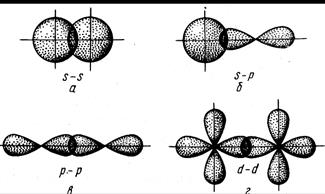 Рис. 2.3. Перекрывание атомных орбиталей при образовании σ-связей
Рис. 2.3. Перекрывание атомных орбиталей при образовании σ-связей
| Сигма-связь может возникать при перекрывании s-орбиталей (рис. 2.3, а), s- и р-орбиталей (рис. 2.3, б), d-орбиталей (рис. 2.3, в), а также d- и s-орбиталей, d- и р-орбиталей и f-орбиталей друг с другом и другими орбиталями. Сигма-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью. |
Кратные связи.Кроме простых σ-связей существуют кратные (двойные и тройные) связи, которые образуются при наложении σ-, π- и δ-связей.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью.
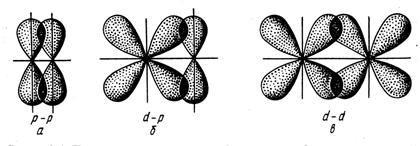 Рис. 2.4. Перекрывание атомных орбиталей при образовании π-связей
Рис. 2.4. Перекрывание атомных орбиталей при образовании π-связей
| Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 2.4, а), р – d-орбиталей (рис. 2.4, б), d – d-орбиталей (рис. 2.4, в), а также f – p-, f – d- и f – f-орбиталей. |
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью.
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы - σ- и π-связи, d-элементы - σ-, π- и δ-связи, а f-элементы - σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, диоксида углерода. Кратная связь изображается двумя черточками: О=О, О=С=О.
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи (табл. 2.1.).
Число связей между атомами называется кратностью связи.
В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т.е. охватывающими не два атома, а часть или целые молекулы или ионы.
Донорно-акцепторный механизм образования ковалентной связи. Донорно-акцепторная связь - разновидность ковалентной связи.
Если одна из двух молекул имеет атом со свободными орбиталями, а другая – атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например у иона аммония  атом азота образует четыре ковалентные связи с водородом, хотя у атома азота всего три неспаренных электрона.
атом азота образует четыре ковалентные связи с водородом, хотя у атома азота всего три неспаренных электрона.
Азот молекулы аммиака, имеющий три ковалентные связи с тремя атомами водорода по обменному механизму, имеет неподеленную пару электронов
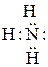 ,
,
которая может взаимодействовать со свободной орбиталью иона водорода Н+, образуя четвертую ковалентную связь:
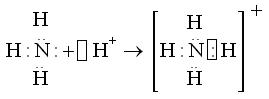
Четвертая ковалентная связь, образованная по донорно-акцепторному механизму, характеризуется теми же параметрами, что и остальные три ковалентные связи, образованные по обменному механизму, т.е. в ионе аммония все четыре связи равноценны.
Ковалентная связь по донорно-акцепторному механизму образуется при взаимодействии многих атомов, ионов и молекул. Например,
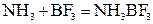
|
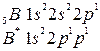



Атом азота отдает на связь пару электронов, а атом бора – вакантную орбиталь.
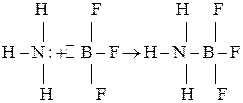
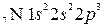
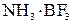 – комплексное соединение
– комплексное соединение
В полученном соединении суммарные валентности бора и азота равны 4.
Аналогичным путем образуется комплексное соединение  при взаимодействии
при взаимодействии 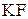 и
и  , которое записывается
, которое записывается 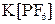 .
.
Атом, предоставляющий электронную пару, называется донором, а атом, представляющий свободную орбиталь называется акцептором.
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, называются комплексными или координационными соединениями.
Донорно-акцепторная связь обладает такими же свойствами, как и ковалентная связь: насыщаемостью и направленностью.
Валентность – общее число химических связей, которые образуют один атом элемента в молекуле определенного соединения.
Ковалентность – определяют по общему числу ковалентных и донорно-акцепторных связей, которые образует один атом элемента в молекуле.
Дата добавления: 2020-03-21; просмотров: 584;











