Периодические свойства элементов
Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие как энергия ионизации, размеры атомов, окислительно-восстановительные и другие свойства.
Размеры атомов и ионов.Вследствие волновой природы электрона атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов, но также и от вида химической связи между ними.
Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
| Li | Be | B | C | N | O | F | |
| r, нм | 0,155 | 0,113 | 0,091 | 0,077 | 0,071 | 0,066 | 0,064 |
Это объясняется увеличением притяжения электронов внешнего слоя к ядру по мере возрастания заряда ядра. В подгруппах сверху вниз атомные радиусы возрастают, т.к. увеличивается число электронных слоев:
| r, нм | r, нм | ||
| Li | 0,155 | N | 0,071 |
| Na | 0,189 | P | 0,130 |
| K | 0,236 | As | 0,148 |
| Rb | 0,248 | Sb | 0,161 |
| Cs | 0,268 | Bi | 0,182 |
Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус положительного иона (катиона) всегда меньше, а радиус отрицательного иона (аниона) всегда больше, чем радиус соответствующего электронейтрального атома. Например:
| r, нм | r, нм | ||
| K0 | 0,236 | Cl0 | 0,099 |
| K+ | 0,133 | Cl– | 0,181 |
Радиус иона тем сильнее отличается от радиуса атома, чем больше заряд иона:
| Cr0 | Cr2+ | Cr3+ | |
| r, нм | 0,127 | 0,083 | 0,064 |
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра:
| r, нм | r, нм | ||
| Li+ | 0,068 | F– | 0,133 |
| Na+ | 0,098 | Cl– | 0,181 |
| K+ | 0,133 | Br– | 0,196 |
| Rb+ | 0,149 | I– | 0,220 |
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.
Энергия ионизации и сродство к электрону. В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации (потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона:
X – e → X+
Энергия ионизации измеряется в кДж/моль или в электронвольтах
1 эВ = 1,602.10-19 Дж или 96,485 кДж/моль. (эВ). Отрыв второго электрона происходит труднее, чем первого, т.к. второй электрон отрывается не от нейтрального атома, а от положительного иона:
X+ – e → X2+
Поэтому второй потенциал ионизации I2 больше, чем первый (I2>I1). Очевидно, что удаление каждого следующего электрона будет требовать больших энергетических затрат, чем удаление предыдущего. Для характеристики свойств элементов обычно принимают во внимание энергию отрыва первого электрона.
В группах потенциал ионизации уменьшается с увеличением атомного номера элемента:
| Li | Na | K | Rb | Cs | |
| I, эВ | 6,39 | 5,14 | 4,34 | 4,18 | 3,89 |
Это связано с большей удаленностью валентных электронов от ядра и, следовательно, с их более легким отрывом по мере увеличения количества электронных слоев. Величина потенциала ионизации может служить мерой “металличности” элемента: чем меньше потенциал ионизации, тем легче удалить электрон из атома, тем сильнее выражены металлические свойства.
В периодах слева направо заряд ядра возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают:
| Li | Be | B | C | N | O | F | Ne | |
| I, эВ | 5,39 | 9,32 | 8,30 | 11,26 | 14,53 | 13,61 | 17,42 | 21,56 |
Нарушение тенденции возрастания I наблюдается для атомов с целиком заполненным внешним энергетическим подуровнем, либо для атомов, у которых внешний энергетический подуровень заполнен ровно наполовину:
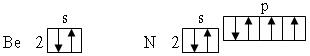
Это свидетельствует о повышенной энергетической устойчивости электронных конфигураций с полностью или наполовину занятыми подуровнями.
Степень притяжения электрона к ядру и, следовательно, потенциал ионизации зависят от ряда факторов, и прежде всего от заряда ядра. Заряд ядра равен порядковому номеру элемента в таблице Менделеева., от расстояния между электроном и ядром, от экранирующего влияния других электронов. Так, у всех атомов, кроме элементов первого периода, влияние ядра на электроны внешнего слоя экранировано электронами внутренних слоев.
Поле ядра атома, удерживающее электроны, притягивает также и свободный электрон, если он окажется вблизи атома. Правда, этот электрон испытывает отталкивание со стороны электронов атома. Для многих атомов энергия притяжения дополнительного электрона к ядру превышает энергию его отталкивания от электронных оболочек. Эти атомы могут присоединять электрон, образуя устойчивый однозарядный анион.
Энергию отрыва электрона от отрицательного однозарядного иона в процессе
X– – e → X0
называют сродством атома к электрону (A), измеряемым в кДж/моль или 1 эВ (электронвольт) = 1,602.10-19 Дж или 96,485 кДж/моль.. При присоединении двух и более электронов к атому отталкивание преобладает над притяжением – сродство атома к двум и более электронам всегда отрицательно. Поэтому одноатомные многозарядные отрицательные ионы (O2–, S2–, N3– и т.п.) в свободном состоянии существовать не могут.
Сродство к электрону известно не для всех атомов. Максимальным сродством к электрону обладают атомы галогенов.
Электроотрицательность.Эта величина характеризует способность атома в молекуле притягивать к себе связующие электроны. Электроотрицательность не следует путать со сродством к электрону: первое понятие относится к атому в составе молекулы, а второе – к изолированному атому. Абсолютная электроотрицательность (кДж/моль или 1 эВ электронвольт = 1,602.10-19 Дж или 96,485 кДж/моль. ) равна сумме энергии ионизации и сродства к электрону:
АЭО=I+A.
На практике часто применяется величина относительной электроотрицательности, равная отношению АЭО данного элемента к АЭО лития (535 кДж/моль):
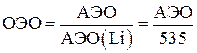
Электроотрицательность уменьшается сверху вниз по группе и увеличивается слева направо по периоду. Ниже приведены относительные электроотрицательности некоторых элементов:
| Li | Be | B | C | N | O | F | |
| ОЭО | 1,0 | 1,5 | 2,0 | 2,5 | 3,1 | 3,5 | 4,0 |
| Na | K | Rb | Cs | |
| ОЭО | 0,9 | 0,8 | 0,8 | 0,7 |
| Cl | Br | I | |
| ОЭО | 3,0 | 2,8 | 2,6 |
Наибольшее значение электроотрицательности имеет фтор, наименьшее – цезий. Водород занимает промежуточное положение, т.е. при взаимодействии с одними элементами (например, с F) он отдает электрон, а при взаимодействии с другими (например, с Rb) – приобретает электрон.
Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону.
Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
| Na+ | Mg2+ | Al3+ | Si4+ | P5+ | S6+ | Cl7+ |
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
| основные | амфотерный | слабо кислотный | средне кислотный | сильно кислотные |
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются:
| B3+ | H3BO3 | слабая кислота |
| Al3+ Ga3+ In3+ | Al(OH)3 Ga(OH)3 In(OH)3 | амфотер- ные гидрок- сиды |
| Tl3+ | Tl(OH)3 | более выражены основные свойства |
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду H2SO4 серная кислота, H2SeO4 селеновая кислота, H2TeO4 теллуровая кислота.
Дата добавления: 2020-03-21; просмотров: 531;











