Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержит небольшое количество электронов.
Для примера рассмотрим кристаллическую решетку натрия.
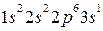
Валентный электрон (3s1) может занимать одну из девяти свободных орбиталей. При сближении атомов валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую и принадлежат всем атомам.
При сближении атомов валентные орбитали соседних атомов перекрываются, благодаря чему электроны свободно перемещаются из одной орбитали в другую и принадлежат всем атомам. Согласно теории свободных электронов, в узлах решетки металла находятся положительно заряженные ионы, которые погружены в электронный «газ», распределенный по всему металлу. Таким образом, валентные электроны у металлов не локализованы. Между положительно заряженными ионами металла и нелокализованными электронами существует электростатическое взаимодействие, обеспечивающее устойчивость вещества. Энергия этого взаимодействия является промежуточной между энергиями ковалентных и молекулярных кристаллов. Поэтому элементы с чисто металлической связью (s- и р-металлы) характеризуются относительно невысокими температурами плавления и твердостью.
Наличие электронов, которые могут свободно перемещаться по объему кристалла, обеспечивает высокие электрическую проводимость и теплопроводность, а также ковкость и пластичность металлов. Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов.
Из-за ненапрвленности связей, сферической формы и одинакового размера ионов металлы кристаллизуются, как правило, в плотноупаованных гексагональных или гранецентрированных структурах.
Водородная связь
Химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы –А-Н) и электроотрицательным атомом В другой или той же молекулы, называется водородной связью. Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутимолекулярной. Водородная связь между молекулами А-Н и В-R обозначается тремя точками
А-Н + В-R → А-Н…В-R
Водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлен тем, что в полярных молекулах А-Н или полярных группах –А-Н поляризованный атом водорода обладает уникальными свойствами: осутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Атомы А и В могут быть одинаковыми, как при взаимодействии HF
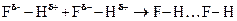
но могут быть и разными, как при взаиодействии воды и фтороводорода.
Энергия водородной связи возрастает с увеличением электроотрицательности и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, O или N. Несмотря на высокую электроотицательность у хлора, водородная связь –Н…Cl- относительно слабая из-за большого размера атома хлора. Длины водородных связей имеют промежуточное значение. Например, у воды длина связи О-Н – 0,096 нм, а связи О…Н – 0,177 нм.
При возникновении водородных связей образуются димеры, триммеры или полимерные структуры, например зигзагообразные структуры (HF)n или более сложные конфигурации, например у льда:
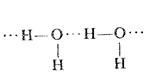
Образование межмолекулярных вдородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления и парообразования. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются химические свойства. Например, HF – слабая кислота, в то время ее аналог HCl – сильная кислота.
Так как многие соединения содержат ковалентные полярные связи Н-О и H-N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах. Например, практически все соли образуют кристаллогидраты, в которых имеются водородные связи.
Важную роль водородные связи играют в белках, у кторых спиральные полимерные стуктуры объединяются связями N-H…O. Двойные спирали нуклеиновых кислот соединяются межмолекулярными водородными связями N-H…N и N-H…O.
Дата добавления: 2020-03-21; просмотров: 551;











