Гибридизация атомных орбиталей
При образовании химических связей нередко участвуют электроны различных подуровней одного и того же атома, например s- и р-электроны. Однако, возникающие при этом связи обладают близкими значениями энергии. Чем это объяснить?
Американский ученый Л. Полинг выдвинул идею о гибридизации атомных орбиталей. Согласно этой идее, если у атома, вступающего в химическую связь, имеются разные АО (s-, p-, d- или f-АО), то в процессе образования химической связи происходит гибридизация (смешение) АО, т.е. из разных АО образуются одинаковые (эквивалентные) АО. Форма гибридных АО отличается от формы исходных АО (рис. 2.5.).
| В гибридной АО электронная плотность смещается в одну сторону от ядра, поэтому при взаимодействии ее с АО другого атома происходит максимальное перекрывание, которое приводит к повышению энергии связи. Это повышение энергии связи компенсирует энергию, требуемую на образование гибридной орбитали. В результате химические связи, образованные гибридными орбиталями, прочнее, а полученная молекула более устойчива. | 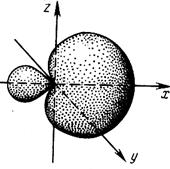 Рис. 2.5. Атомная sp-гибридная орбиталь
Рис. 2.5. Атомная sp-гибридная орбиталь
|
Если в химическую связь вступает атом, у которого на внешней оболочке имеются s- и р-электроны, то у данного атома в процессе образования связи происходит sp-гибридизация АО (рис. 2.6.).
 Рис. 2.6. Схема sp-гибридизации
Рис. 2.6. Схема sp-гибридизации
|
Если у атома, вступающего в химическую связь, на внешней оболочке один s- и два р-электрона, то происходит sp2-гибридизация АО этого атома (рис.2.7.).
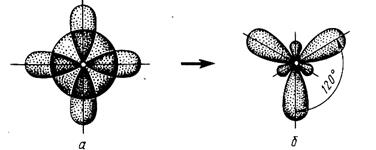 Рис. 2.7. Схема sp2-гибридизации
Рис. 2.7. Схема sp2-гибридизации
|
У атома, имеющего на внешней оболочке один s- и три р-электрона, при химическом взаимодействии происходит sp3-гибридизация этих АО (рис. 2.8.).
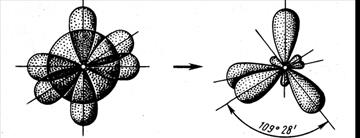 Рис. 2.8. Схема sp3-гибридизации
Рис. 2.8. Схема sp3-гибридизации
|
Возможны также более сложные виды гибридизации с участием d- и f-орбиталей атомов.
Некоторые наиболее распространенные типы гибридизации и соответствующие им геометрические формы молекул приведены в табл. 2.3.
Таблица 2.3. Некоторые типы гибридизации и геометрия молекул
| Число внешних орбиталей центрального атома | Тип гибридизации | Форма геометрии молекул |
| sp | Линейная | |
| sp2 | Плоская тригональная | |
| sp3 | Тетраэдрическая | |
| sp3d | Тригональная бипирамида | |
| sp3d2 | Октаэдрическая | |
| sp3d3 | Пентагональная бипирамида |
Ниже рассмотрены примеры различных видов гибридизации s- и p-орбиталей.
Гибридизация одной s- и одной p-орбитали (sp-гибридизация) происходит, например, при образовании галогенидов бериллия, цинка, кадмия и ртути. Атомы этих элементов в нормальном состоянии имеют во внешнем слое два спаренных s-электрона. В результате возбуждения один из s-электронов переходит в p-состояние – появляется два неспаренных электрона, один из которых s-, а другой p-электрон. При образовании химической связи эти две различные орбитали преобразуются в две одинаковые гибридные орбиталиОбщее количество орбиталей при гибридизации не изменяется. (sp-орбитали), направленные под углом 180˚ друг к другу, – две связи имеют противоположное направление (рис. 2.9).
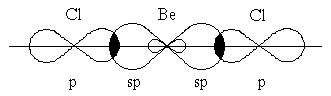
Рис. 2.9. Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2
Экспериментальное определение структуры молекул BeГ2, ZnГ2, CdГ2, HgГ2 (Г–галоген) показало, что эти молекулы являются линейными, и обе связи металла с атомами галогена имеют одинаковую длину.
Гибридизация одной s- и двух p-орбиталей (sp2-гибридизация) имеет место, например, при образовании соединений бора. Возбужденный атом бора обладает тремя неспаренными электронами – одним s-электроном и двумя p-электронами. Из трех орбиталей образуются три эквивалентные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120˚ друг к другу (рис. 2.10.). Действительно, как показывают экспериментальные исследования, молекулы таких соединений бора, как BГ3 (Г-галоген), B(CH3)3 – триметилбор, B(OH)3 – борная кислота, имеют плоское строение. При этом три связи бора в указанных молекулах имеют одинаковую длину и расположены под углом 120˚.
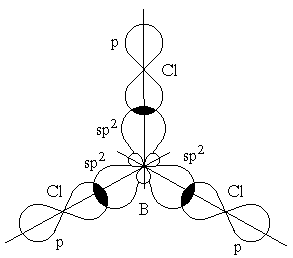
Рис. 2.10. Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3
Гибридизация одной s- и трех p-орбиталей (sp3-гибридизация) характерна, например, для углерода и его аналогов – кремния и германия. В этом случае четыре гибридные sp3-орбитали расположены под углом 109˚28' друг к другу; они направлены к вершинам тетраэдра (в молекулах CH4, CCl4, SiH4, GeBr4 и др.). Валентные углы в молекулах H2O (104˚27') и NH3 (107˚48') не точно соответствуют взаимному расположению “чистых” p-орбиталей (90˚). Это обусловлено некоторым вкладом s-электронов в образование химической связи. Такой вклад есть не что иное, как гибридизация. Валентные электроны в этих молекулах занимают четыре орбитали, которые близки к sp3-гибридным. Незначительное отличие валентных углов от тетраэдрических 109˚28' объясняется тем, что гибридизация в данном случае является неполной.
Во многих молекулах центральный атом не подвергается гибридизации. Так, валентные углы в молекулах H2S, PH3 и др. близки к 90˚, т.е. образование связей происходит с участием “чистых” p-орбиталей, расположенных под прямым углом друг к другу.
Дата добавления: 2020-03-21; просмотров: 667;











