Решение типовых задач
Пример 1.Определить последовательность заполнения электронами подуровней в атомах элементов, если их суммы п + l соответственно равны 4 и 5.
Решение. Напишем для каждого из случаев возможные значения:
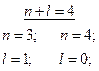
| 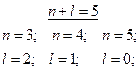
|
| Последовательность заполнения подуровней | |
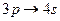
| 
|
Следует иметь в виду, что разница в энергии у орбиталей 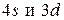 сравнительно невелика, благодаря чему последовательность заполнения
сравнительно невелика, благодаря чему последовательность заполнения  может быть нарушена (см. Cr и Cu). Различие энергетических состояний, по-видимому, еще меньше в случае
может быть нарушена (см. Cr и Cu). Различие энергетических состояний, по-видимому, еще меньше в случае  (см. Nb, Mo, Ru, Rh, Pd, Ag) и особенно
(см. Nb, Mo, Ru, Rh, Pd, Ag) и особенно  (см. лантаноиды).
(см. лантаноиды).
Пример 2.Написать электронные формулы атомов кальция и титана. К какому семейству элементов они относятся?
Решение. Кальций и титан – элементы IV периода и атомы их имеют 4 электронных слоя. У кальция (Z = 20), следующего через один элемент после аргона (Z = 18), заполняется двумя электронами подуровень  . Электронная формула кальция
. Электронная формула кальция
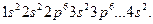
После заполнения подуровня  электроны поступают в подуровень
электроны поступают в подуровень 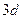 и поэтому электронная формула титана, атомный номер которого на 2 единицы больше, чем у кальция, имеет вид:
и поэтому электронная формула титана, атомный номер которого на 2 единицы больше, чем у кальция, имеет вид:
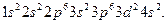
Кальций – s –элемент, а титан 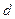 -элемент.
-элемент.
Пример 3.Написать электронные формулы атомов хрома, меди и германия. К какому семейству элементов они относятся?
Решение. У элементов IV периода хрома (Z = 24) и меди (Z = 29), атомы которых имеют 4 электронных слоя, происходит, начиная от Sc, заполнение подуровня 3  и поэтому следовало бы ожидать, что их формулы будут иметь вид
и поэтому следовало бы ожидать, что их формулы будут иметь вид
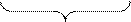
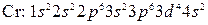
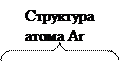 |
Однако в действительности расположение электронов на внешних уровнях атомов этих элементов выражается соответственно формулами 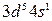 и
и 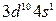 , что объясняется провалом одного из электронов подуровня
, что объясняется провалом одного из электронов подуровня 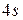 на подуровень
на подуровень 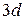 . Атом германия (Z = 32) содержит сверх электронной структуры аргона (Z = 18) 14 электронов, заполнение которыми происходит в такой последовательности:
. Атом германия (Z = 32) содержит сверх электронной структуры аргона (Z = 18) 14 электронов, заполнение которыми происходит в такой последовательности:
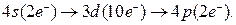
Электронная формула германия имеет вид
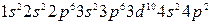
Хром и медь относятся к семейству  -элементов, а германий – к семейству р-элементов.
-элементов, а германий – к семейству р-элементов.
Пример 4.Написать электронно-графические формулы атомов бериллия и бора в нормальном и в возбужденном состоянии.
Решение. Электронные формулы бериллия – 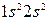 и бора -
и бора - 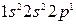 могут быть представлены структурами:
могут быть представлены структурами:

бериллий бор
Такие электронные структуры соответствуют нормальному, т.е. невозбужденному, состоянию их атомов. Однако наличие на втором уровне вакантных орбиталей в подуровне  делает возможным возбуждение этих электронов до
делает возможным возбуждение этих электронов до  -состояния с затратой сравнительно небольшого количества энергии, которое впоследствии полностью и даже с избытком компенсируется энергией, освобождающейся при образовании новых связей. Электронные формулы возбужденных атомов бериллия и бора
-состояния с затратой сравнительно небольшого количества энергии, которое впоследствии полностью и даже с избытком компенсируется энергией, освобождающейся при образовании новых связей. Электронные формулы возбужденных атомов бериллия и бора 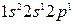 и
и 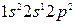 , а их структуры имеют следующий вид:
, а их структуры имеют следующий вид:
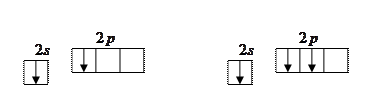
бериллий бор
В таком состоянии валентность Ве и В равна соответственно двум и трем.
Пример 5.Написать электронно-графические формулы атомов азота и кислорода.
Решение. Электронные формулы атомов азота и кислорода:
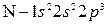 и
и 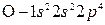 .
.
Возможны два варианта графических формул р-подуровня:
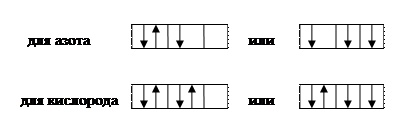
Из них обладают наименьшим запасом энергии, и, следовательно, энергетически более предпочтительны вторые варианты, отвечающие правилу Гунда, согласно которому наименьшим запасом энергии обладают атомы, у которых в пределах данного значения l электроны располагаются так, чтобы число неспаренных электронов с параллельными спинами было максимальным.
Пример 6.Написать электронную формулу атома железа. Как распределяются в нем электроны d-подуровня и какова высшая валентность железа?
Решение. В зависимости от значения п электроны по отдельным уровням K, L, M и т.д. распределяются в атоме железа (Z = 26) следующим образом: 2, 8, 14, 2, а электронная формула имеет вид
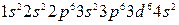 .
.
Энергетически наиболее выгодному распределению шести d-электронов отвечает схема

После возбуждения подуровня 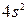 и перехода одного s-электрона на подуровень 4р общее число непарных электронов равно 6, что и соответствует высшей валентности железа.
и перехода одного s-электрона на подуровень 4р общее число непарных электронов равно 6, что и соответствует высшей валентности железа.
Пример 7.Написать электронные формулы трех последних квантовых уровней атомов церия и гадолиния. Как распределяются в них электроны подуровней  ?
?
Решение. Электронная формула трех последних квантовых уровней имеет для атома ксенона (Z = 54) следующий вид:
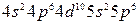 .
.
Атомы церия (Z = 58) и гадолиния (Z = 64) обладают сверх этой структуры соответственно четырьмя и десятью электронами, которые распределяются следующим образом:

Дата добавления: 2020-03-21; просмотров: 546;











