Строение твердого тела
Твердые вещества могут находиться в аморфном или кристаллическом состоянии.
Таблица 2.4. Различия между аморфными и кристаллическими телами
| Аморфные | Кристаллические |
| 1) Не имеют определенной температуры плавления и температуры кристаллизации (тело постепенно разлагается, растекается) также постепенно затвердевает | 1) Имеют строго определенную температуру плавления и температуру кристаллизации. |
| 2) Подобно жидкостям текучи (кусок смолы в теплой комнате за несколько недель принимает форму диска) | 2) Не текучи |
| 3) Упорядоченность структуры наблюдается только на малых участках, структура аморфных тел характеризуется ближним порядком. | 3) В кристалле частицы расположены упорядоченно, на больших участках. Структура кристаллов характеризуется дальним порядком. |
| 4) Излом гладкий и ограничен овальными поверхностями. | 4) Излом ограничен плоскими поверхностями. |
Из аморфных веществ наиболее известно стекло, поэтому аморфное состояние еще называют стеклообразным. В аморфном соотоянии также могут находиться многие полимеры, смолы, простые вещества (Se, Si, Ag и др.), оксиды (SiO2, GeO2, B2O3 и др.), сульфаты, карбонаты, некоторые многокомпонентные неорганические соединения. Аморфные вещества изотропны, т.е. имеют одинаковые свойства во всех направлениях.
Подавляющее большинство твердых тел находятся в кристаллическом состоянии, поэтому в дальнейшем будет рассмотрено лишь это состояние.
Кристаллическая решетка. Упорядоченное расположение частиц в твердом теле изображается в виде решетки, в узлах которой находятся те или иные частицы, соединенные воображаемыми линиями. Монокристаллы характеризуются анизотропностью, т.е. зависимостью свойств от напрвления в пространстве. Следует, однако, отметить, что реальные вещества поликристаллические, т.е. состоят из множества кристаллов, ориентированных по разным осям координат, поэтому в поликристаллических телах анизотропия не проявляется.
1. В узлах молекулярных решеток находятся молекулы.
2. В узлах атомных решеток находятся атомы.
3. В узлах ионных решеток находятся, чередуясь положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения.
4. В узлах металлических решеток находятся атомы металлов, между которыми свободно движутся общие для этих атомов электроны.
Характеристики кристаллической решетки:
1. Координационное число – число частиц, непосредственно примыкающих к данной частице в кристалле. Чем больше координационное число, тем плотнее упаковка кристалла.
2. Постоянная решетки характеризует расстояние между центрами частиц, занимающих узлы в кристалле.
3. Энергия кристаллической решетки – энергия, необходимая для разрушения 1 моля кристалла и удаления частиц за пределы их взаимодействия. Если в узлах решетки находятся атомы или молекулы, то энергия решетки называется энергией сублимации. Единицей измерения энергии решетки, как и энергии химических связей, является кДж/моль.
4. Элементарная ячейка – наименьшая часть кристалла, имеющая все особенности структуры данной решетки. При многократном повторении ячейки по трем измерениям получают всю кристаллическую решетку. Имеется семь основных ячеек (рис.2.11.)

|
| Рис. 2.11. Геометрические фигуры, отвечающие элементарным ячейкам |
Таблица 2.5. Типы кристаллов и свойства веществ
| Вид частиц в узлах | Тип кристаллов | |||
| Свойства веществ | молекулярные | атомно-ковалентные | ионные | металлические |
| Частицы | Молекулы | Атомы | Ионы | Ионы |
| Тип связей между частицами | Вадерваальсовы силы, водородные | Ковалентные | Ионные | Металлические |
| Энергия связей | Невысокая | Высокая | Высокая | От средней до высокой |
| Температура плавления | Низкая | Высокая | Высокая | От низкой до высокой |
| Механические свойства | Мягкие | Очень твердые | Твердые и хрупкие | От мягких до очень твердых |
| Электрическая проводимость | Диэлектрики | От диэлектриков до полупроводников | Диэлекрики | Электронная |
| Примеры веществ | Ar, O2, N2, CO2, H2O | C, Ge, Si, SiO2,SiC | KCl, CaF2, Na2CO3 | Li, Ca, Zn, Ni |
Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами. Частицы размещаются в решетке таким образом, чтобы энергия системы была минимальна. Для частиц сферической формы это достигается при максимальном координационном числе, т.е. при наиболее плотной упаковке (рис.2.12.).
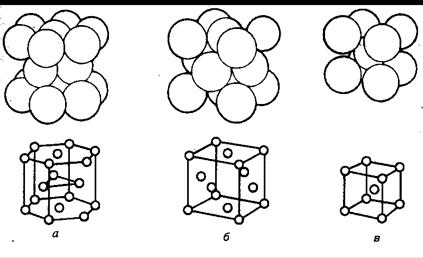
|
| Рис.2.12. Трехмерное изображение упаковок шаров: а) гексагональная; б) кубическая гранецентрированная; в) кубическая объемно центрированная |
Некоторые вещества близкой химической природы образуют одинаковые кристаллические структуры. Такие вещества называют изоморфными. В таких структурах частицы могут замещать друг друга, например Mg2+ и Ca2+ в Сa2SiO4 и Mg2SiO4 или К+ и Rb+, а также Al3+ и Cr3+ в квасцах KAL(SO4)2 ∙ 12H2O. При замещении даже части ионов могут изменяться свойства вещества. Например, при замещении части Al3+ в корунде Al2O3 на ионы Cr3+ прозрачные кристаллы становятся красными (рубин), а на ионы Ti3+ и Fe3+ - синими (сапфир).
Многие соединения могут существовать также в двух или более кристаллических структурах. Такое явление называется полиморфизмом. В качестве примера полиморфизма можно указать существование SiO2 в виде гексагонального кварца, ромбического тридимита и кубического кристобалита. Полиморфные модификации существуют и у большинства простых веществ, в этом случае они называются аллотропными (по форме) модификациями. В качестве примера можно назвать аллотропные модификации углерода: алмаз, графит, карбин и фуллерен.
Дефекты в реальных кристаллах. Реальные твердые тела не педставляют собой идеального монокристалла, простирающегося по всему объему вещества, а состоят из отдельных монокристаллов, называемых кристаллитами, сросшихся друг с другом и имеющих межкристаллитную границу раздела. Отдельные кристаллиты в свою очередь имеют несовершенства, называемые дефектами.
Различают точечные, линейные и плоские дефекты.
 Рис.2.13. Точечный дефект в ионном кристалле в узле решетки (а) при переходе иона в междоузлие (б)
Рис.2.13. Точечный дефект в ионном кристалле в узле решетки (а) при переходе иона в междоузлие (б)
| 1) Точечныедефекты – это либо отсутствие иона или атома в узлах решетки (вакансии) (рис.2.13, а), либо ионы или атомы, находящиеся между узлами решетки (рис.2.13, б). Точечные дефекты оказывают большое влияние на свойства полупроводниковых материалов. Вакансии переходят с одного места на другое. |
2) Линейные дефекты структуры называются дислокациями. Простейший вид дислокации - краевая дислокация – это обрывающийся край одной из атомных плоскостей внутри кристалла. Дислокации, подобно точечным дефектам, подвижны, особенно в металлических кристаллах.
3) Плоские дефекты представляют собой комбинации большого числа точечных и линейных дефектов.
Примесные дефекты обусловлены теми или иными примесями, попадающими в твердое тело при его кристаллизации. Такие примеси могут вызывать полупроводниковые свойства некоторых твердых тел с ковалентными кристаллами.
Из-за наличия дефектов некоторые ионные кристаллы имеют ионную проводимость. Такие твердые вещества, обладающие ионной проводимостью, называются твердыми электролитами.
Дата добавления: 2020-03-21; просмотров: 548;











