Электролиты. Электролиз. Законы электролиза
Электролиты – это жидкие или твердые вещества и системы, в которых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрического тока (ионную проводимость).
Надо отметить, что в общем случае электролитами являются не только растворы кислот, солей и щелочей, но и ряд химических соединений как в жидком, так и в твердом состоянии. Примером твердого электролита может служить стекло, которое по своей физической природе является сильно переохлажденной жидкостью с очень большой вязкостью.
 Молекулы электролита и растворителя являются дипольными. Поэтому в растворе каждую молекулу электролита окружает группа молекул растворителя, приблизительно так как показано на рис. 7.15.
Молекулы электролита и растворителя являются дипольными. Поэтому в растворе каждую молекулу электролита окружает группа молекул растворителя, приблизительно так как показано на рис. 7.15.
Молекулы растворителя стремятся как бы разорвать молекулу электролита на две части. Этому способствует также тепловое движение – колебание атомов в молекуле электролита. В результате большинство молекул электролита распадается на положительные ионы (катионы) и отрицательные ионы (анионы).
Процесс распада веществ в растворе под влиянием электрического поля на отдельные положительно и отрицательно заряженные ионы называется электролитической диссоциацией.
 Обратному процессу – воссоединению (рекомбинации) ионов электролита в нейтральные молекулы – препятствует образующаяся на ионах сольватная оболочка, состоящая из молекул растворителя (рис. 7.16).
Обратному процессу – воссоединению (рекомбинации) ионов электролита в нейтральные молекулы – препятствует образующаяся на ионах сольватная оболочка, состоящая из молекул растворителя (рис. 7.16).
По способности к электролитической диссоциации a электролиты условно делятся на сильные (a ~ 1) и слабые (a близка к нулю).
К сильным электролитам относятся соли, некоторые органические кислоты и основания, к слабым – органические кислоты и основания.
Степень диссоциации зависит от природы растворителя, температуры, давления и других факторов.
Совокупность электрохимических процессов, проходящих на электродах, погруженных в электролит, при прохождении по нему электрического тока, называется электролизом.
Согласно первому закону электролиза (Фарадея), масса m выделившегося на аноде вещества пропорциональна времени t прохождения через электролит тока и силе тока I:
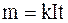 , (7.46)
, (7.46)
где k – коэффициент пропорциональности, называемый электрохимическим эквивалентом данного вещества.
Второй закон Фарадея устанавливает связь электрохимического эквивалента с химическим эквивалентом вещества ( 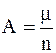 ):
):
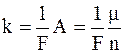 , (7.47)
, (7.47)
где m – молярная (или атомная) масса;
n – заряд иона (в единицах величины заряда электрона e);
F – постоянная Фарадея, численно равная заряду, который должен пройти через электролит, чтобы на электроде выделилась масса вещества, численно равная k.
Заряд переносят ионы, количество которых в массе вещества численно равно химическому эквиваленту 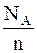 , где NA – число Авогадро (число молекул в грамм-молекуле). Поэтому
, где NA – число Авогадро (число молекул в грамм-молекуле). Поэтому
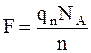 , (7.48)
, (7.48)
где qn – заряд одного иона.
Так как заряд иона qn = ne, то F = eNA = 96 500 Кл/моль.
Дата добавления: 2016-06-22; просмотров: 2575;











