УРАВНЕНИЕ КЛАПЕЙРОНА – КЛАУЗИУСА.
В системе, состоящей из нескольких фаз чистого вещества, возможны переходы вещества из одной фазы в другую. Такие переходы называют фазовыми переходами. Фазовые переходы характеризуются зависимостью температуры фазового превращения от внешнего давления или давления насыщенного пара от температуры системы. Уравнение, характеризующее такие зависимости, предложено Клапейроном и и позже модифицировано Клаузиусом.
Пусть 1 моль вещества равновесно переходит из одной фазы (1) в другую (2) при р, Т = const. Ограничимся рассмотрением фазовых переходов первого рода, для которых характерно равенство изобарных потенциалов двух фаз и скачкообразное изменение энтропии S и объёма V. К фазовым переходам первого рода относятся следующие изотермические переходы:
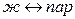 (испарение),
(испарение),
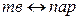 (сублимация),
(сублимация),
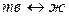 (плавление, кристаллизация).
(плавление, кристаллизация).
Условием равновесием является равенство мольных энергий Гиббса вещества в двух фазах: G1 = G2. Если р и Т одновременно изменяются на dp и dT, то G тоже изменится на dG и новое условие равновесия запишется как
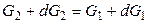 , (11)
, (11)
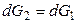 , (12)
, (12)
Из соотношения (2.40) 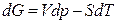 следует, что
следует, что
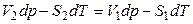 ,
,
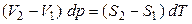 , (13)
, (13)
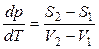 , т. е.
, т. е. 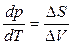 . (14)
. (14)
С учетом того, что
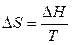 , (15)
, (15)
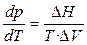 , (16)
, (16)
где DV = V2 – V1 — разность мольных объёмов двух фаз, DS и DH – изменение энтропии и энтальпии вещества при переходе 1 моля вещества из одной фазы (1) в другую (2). Уравнение (4.16) называют уравнением Клапейрона–Клаузиуса. Оно устанавливает связь между изменением температуры фазового перехода с изменением внешнего давления или изменением давления насыщенного пара с изменением температуры, с одной стороны, и теплотой фазового перехода и изменением объёма вещества при фазовом переходе, с другой стороны.
1). Рассмотрим применение уравнения (4.16) к процессам плавления. В этом случае уравнение Клапейрона–Клаузиуса обычно используют в следующей форме:
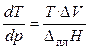 . (17)
. (17)
Поскольку DплН > 0, знак производной 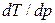 зависит от знака DV. Для большинства веществ
зависит от знака DV. Для большинства веществ
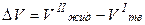 > 0
> 0 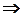
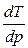 > 0,
> 0,
что соответствует наклону кривой 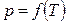 для этого фазового перехода вправо.
для этого фазового перехода вправо.
Для немногих веществ, в том числе для воды, висмута, галлия, чугуна:
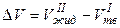 < 0
< 0 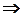
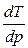 < 0,
< 0,
что соответствует наклону кривой 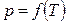 для этого фазового перехода влево.
для этого фазового перехода влево.
Итак, если при плавлении вещества его мольный объем уменьшается,то
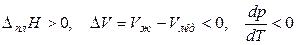 ,
,
т. е. при увеличении внешнего давления температура плавления вещества уменьшается.
Если плавление сопровождается увеличением мольного объема, то
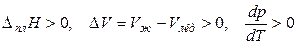 ,
,
т. е. при увеличении внешнего давления температура плавления вещества тоже увеличивается.
2). Рассмотрим применение уравнения (4.16) к процессам испарения и сублимации.
Для процессов испарения или сублимации уравнение Клапейрона – Клаузиуса записывают в виде
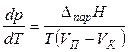 , (18)
, (18)
где VK — объем конденсированной фазы (жидкости VЖ или твердого тела VТВ). При температуре, гораздо ниже критической (при ТКР: VЖ = VП), можно пренебречь объёмом жидкой фазы по сравнению с объёмом того же весового количества пара. В результате уравнение (18) преобразуется в
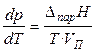 . (19)
. (19)
При невысоких давлениях и температурах к пару можно применить законы идеальных газов ( 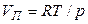 ) и исключить из уравнения (19) объём пара. Тогда
) и исключить из уравнения (19) объём пара. Тогда
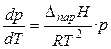 . (20)
. (20)
Окончательно для процесса испарения или сублимации получаем (дифференциальную) форму уравнения Клапейрона – Клаузиуса:
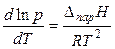 . (21)
. (21)
Если принять DпарН постоянной величиной (что возможно для небольших температурных интервалов), то после интегрирования уравнения (21) получаем интегральную форму уравнения Клапейрона – Клаузиуса:
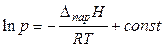 , (22)
, (22)
или
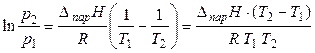 . (23)
. (23)
Эти уравнения устанавливает в явном виде связь теплоты парообразования вещества с зависимостью давления насыщенного пара от температуры.
Итак, для процессов парообразования 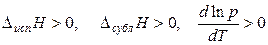 ,
,
т. е с увеличением температуры растет давление насыщенного пара вещества.
В отличие от температуры плавления, температура кипения очень сильно зависит от давления, что связано с большой величиной DV, которой сопровождаются процессы испарения и сублимации.
В отличие от теплоты парообразования, которая изменяется в широких пределах, энтропия парообразования – величина более или менее постоянная. Для многих неорганических и органических веществ выполняется правило Трутона:
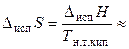 89 Дж/(моль К), (24),
89 Дж/(моль К), (24),
где Тн.т.кип. – нормальная температура кипения жидкости, т.е. температура кипения при внешнем давлении, равном 1 атм.
Дата добавления: 2016-06-18; просмотров: 3322;











