ФАЗОВЫЕ РАВНОВЕСИЯ В ОДНОКОМПОНЕНТНЫХ СИСТЕМАХ.
В однокомпонентных системах при р, Т = const условием равновесия является равенство энергий Гиббса сосуществующих фаз в расчёте на одно и тоже количество вещества (моль, кг). Из соотношения
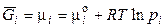
следует, что при равновесии парциальное давление насыщенного пара каждого компонента должно быть одинаковым для всех фаз.
Максимальное число степеней свободы в однокомпонентных системах равно:
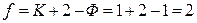 . (9)
. (9)
Состояние таких систем можно описать на плоскости с двумя осями переменных (р и Т).
Максимальное число сосуществующих фаз ( f = 0)в однокомпонентной системе равно
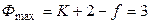 . (10)
. (10)
Система трёхфазная и безвариантная. Это означает, что три фазы находятся в равновесии при строго определенных (и зависимых друг от друга) значениях переменных (температуре и давлении).
Диаграммой состоянияназывается график, выражающий зависимость состояния системы от внешних условий или от состава системы.
Независимые термодинамические параметры – параметры, которые могут быть изменены произвольным образом без изменения числа сосуществующих фаз.
Так, для однокомпонентной системы (К = 1):
1). Ф = 1 Þ f = 2, т.е. в гомогенных системах р и Т можно менять произвольно.
2). Ф = 2 Þ f = 1, следовательно, р может изменяться независимо, а температура является функцией давления (Т = f (р)), т. е. становится зависимым параметром.
3). Ф = 3 Þ f = 0, т.е. температура и давление строго определены. Малейшее изменение любой из этих величин приведёт к исчезновению одной или двух фаз. Например, если рассматривать диаграмму состояния воды (рис. 1), повышение температуры при постоянном давлении или понижение давления при постоянной температуре переводит систему в состояние пара. Повышение при постоянной температуре переводит систему в состояние жидкой воды, а понижение температуры при постояном давлении – в состояние льда.
Дата добавления: 2016-06-18; просмотров: 3091;











