Обменные реакции с образованием осадка
Если в растворе находятся ионы, которые могут образовать малорастворимое соединение, то равновесие смещается в сторону образования осадка.
Динамическое гетерогенное равновесие, установившееся между веществом, находящимся в растворе в виде ионов и его осадком, описывается уравнением
KatxAny Û xKat+ + yAn-
осадок Û раствор
Константа гетерогенного равновесия в данном случае называется произведением растворимости – ПР (произносится «пэ эр»):
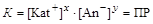 .
.
Величины произведения растворимости приводятся в справочной литературе. Зная величину ПР малорастворимого соединения, можно вычислить его растворимость.
Поскольку соли при растворении в воде полностью диссоциациируют на ионы, то из каждой молекулы образуется x катионов и y анионов. Следовательно, в растворе соли концентрации C [моль/л] концентрации катионов и анионов составят величины: [Kat+] = x×C , [An-] = y×C. Подставив их в выражение ПР, получим
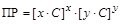 ,
, 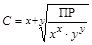 [моль/л].
[моль/л].
Используя справочные значения ПР, можно вычислить молярную концентрацию соли C в растворе.
Пример. Определить растворимость иодида свинца в г/л и концентрацию ионов свинца и иода. ПРРbI2= 8,1×10-9:
РbI2 Û Рb+2 + 2 I-,
ПР = [Рb+2] × [I-]2.
Обозначим концентрацию РbI2 в растворе C. Тогда, согласно уравнению диссоциации, концентрации ионов равны:
[Рb+2] = C, [I-] = 2×C.
Подставив их в уравнение произведения растворимости, можно вычислить концентрацию РbI2 и концентрации ионов:
ПР= C× (2× C)2 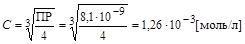 ,
,
[Рb+2] = C = 1,26×10-3моль/л, [I-] = 2×C = 2,52×10-3моль/л.
Растворимость иодида свинца в г/л равна: S = C×М, где M = 461г/моль – молярная масса РbI2:
S = 1,26×10-3× 461 = 0,54 [г/л].
Фазовые равновесия
Совокупность однородных частей системы, обладающих одинаковыми физическими и химическими свойствами,называется фазой. Фазы отделены друг от друга поверхностью раздела. Вещества системы, находящиеся в термодинамическом равновесии друг с другом в одной фазе, образуют фазовое состояние. Равновесный переход вещества из одного фазового состояния в другое называется фазовым переходом. Он характеризуется скачкообразным изменением свойств вещества (теплоемкости, объема, внутренней энергии, энтропии и др.). Система может состоять из одной фазы (гомогенная) или двух и более фаз (гетерогенная).
Переход твердой фазы в жидкость называется плавлением, в газообразное состояние – сублимацией (возгонкой), переход из газообразного и жидкого состояния в твердое – кристаллизацией, переход жидкой фазы в газ – испарением (кипение), обратный переход – конденсацией. Отметим, что многие вещества в твердом состоянии в зависимости от давления и температуры образуют различные кристаллические модификации. То есть в твердом состоянии вещество одного химического состава может находиться в нескольких фазах.
Число видов молекул, необходимое и достаточное для образования всех фаз системы, называется числом компонентов (К). Если в системе протекают реакции превращения одних молекул в другие, то для определения числа компонентов из общего числа видов молекул вычитают число независимых реакций, определяющих эти превращения.
Пример.
1. Система состоит из смеси трех не взаимодействующих газов: N2, Н2O, He. Число компонентов К=3.
2. Система состоит из смеси трех (N2, H2 и NH3) газов, взаимодействующих друг с другом по реакции N2+3H2 Û 2NH3. Число компонентов К=3–1=2.
В гетерогенной системе между фазами устанавливается состояние равновесия. Термодинамическим условием равновесия является равенство нулю изменения энергии Гиббса (DG=0), а кинетическим – равенство скоростей перехода веществ из одной фазы в другую. Число термодинамических параметров равновесия (p-давление, T-температура, C-концентрация), которые могут произвольно изменяться в определенных пределах и при этом не изменяется число фаз в системе и ее строение, называется числом термодинамических степеней свободы (С).
Правило фаз Гиббса
Для анализа состояния равновесия многофазной системы используют правило фаз Гиббса: число степеней свободы системы (С) равно числу компонентов этой системы (К) плюс 2 и минус число фаз (Ф): С=К+2–Ф.
Правило фаз Гиббса является законом, определяющим число термодинамических степеней свободы в зависимости от числа находящихся в состоянии равновесия фаз и числа компонентов, образующих систему. Оно определяет число независимых параметров равновесия, необходимое и достаточное для описания системы. Отметим, что число степеней свободы возрастает с увеличением числа компонентов и уменьшается с ростом числа фаз в системе.
Для определения термодинамических условий равновесного существования фаз служат диаграммы состояния веществ (фазовые диаграммы).
Дата добавления: 2020-02-05; просмотров: 507;











