Гетерогенные реакции
В гетерогенных химических реакциях процесс взаимодействия реагентов протекает на границе раздела фаз (твердое тело – газ, твердое тело – жидкость) и включает в себя три основные стадии (рис.2.11):
· подвод реагирующих веществ к реакционной поверхности;
· собственно химическую реакцию, которая может быть как простой, так и сложной;
· отвод продуктов химической реакции от реакционной поверхности.

Рис. 2.11. Схема протекания гетерогенной реакции nА A(тв) + nВ B ® nD D: SA – реакционная поверхность; JB поток вещества В (подвод реагирующих веществ к реакционной поверхности); cB0 – концентрация вещества В в объеме подвижной фазы; JD - поток вещества D (отвод продуктов химической реакции от реакционной поверхности); cD0 – концентрация вещества D в приповерхностном объеме
Необходимо отметить, что если продукты химической реакции являются твердыми веществами (например, образование на поверхности металла твердого оксида), то это существенно осложнит подвод реагентов из газа или жидкости к поверхности твердого тела.
Общая скорость гетерогенной реакции определяется самой медленной стадией (лимитирующая стадия). Протекание химической реакции описывается законами кинетики, подвод реагентов к реакционной поверхности и отвод продуктов реакции – законами диффузии. В зависимости от того, какая стадия лимитирующая, говорят, что гетерогенные реакции протекают в кинетическом или диффузионном режиме. Если скорости химической реакции и диффузии сравнимы по величине, то говорят, что гетерогенные реакции протекают в смешанном (диффузионно-кинетическом) режиме.
Кинетический режим. Общая скорость процесса определяется законом действующих масс. В случае гетерогенной реакции вероятность встречи реагирующих частиц будет определяться концентрацией веществ, находящихся в газе или жидкости, и числом частиц на поверхности твердого тела. Например, для реакции nА A(тв) + nВ B ® nD D
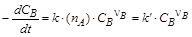 ,
,
где nA = СА×SA – число частиц на поверхности твердого тела; СА – поверхностная концентрация частиц, которая является величиной постоянной, характерной для данного твердого вещества; SA – площадь реакционной поверхности (поверхности фазы, образующей границу раздела, в данном случае поверхность твердого тела), которая в ходе реакции слабо меняется, поэтому в первом приближении можно считать, что SA – величина также постоянная. Следовательно, k¢= k× СА×SA.
Константа скорости, таким образом, зависит от степени дисперсности твердой фазы и ее удельной поверхности (площади поверхности, приходящейся на единицу массы твердого вещества). Температурная зависимость константа скорости описывается уравнением Аррениуса.
Примечание. Как правило, при описании кинетики гетерогенных реакций их скорость рассчитывают на единицу поверхности твердого тела.
Говоря о поверхности твердого тела и ее роли в кинетике гетерогенных реакций, необходимо отметить по крайней мере два обстоятельства. Во-первых, геометрическая поверхность твердого тела по реакционной способности является энергетически неоднородной. Во-вторых, для реагентов, находящихся в газообразной и жидкой фазах, она не равнодоступна. Эти два обстоятельства приводят к тому, что гетерогенная реакция развивается не на всей геометрической поверхности твердого тела, а на так называемых реакционных центрах.
Энергетическая неоднородность поверхности связана с анизотропией свойств кристаллов и наличием дефектов их структуры, а также с формой и микрорельефом поверхности. Для твердого тела, имеющего поверхность сложной геометрической конфигурации (выступы и впадины микро и макрорельефа, наличие пор и т.д.), различные участки поверхности неодинаково доступны для частиц жидкой и газообразной фазы.
Диффузионный режим. Общая скорость химического процесса определяется законами диффузии. Диффузия – процесс выравнивания концентрации вещества в объеме за счет теплового движения частиц.
Диффузионный поток вещества J (масса вещества m, переносимая за единицу времени через единичную площадь) будет пропорционален градиенту концентрации (закон Фика (Fick)):
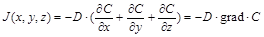 .
.
Таким образом, движущей силой диффузии является неоднородность распределения концентрации вещества по объему.
Коэффициент пропорциональности D называется коэффициентом диффузии. Величина D зависит от температуры и от природы диффундирующих молекул и среды, в которой протекает диффузия. Для газовой среды коэффициент диффузии зависит от давления (при увеличении давления среднее расстояние между молекулами уменьшается, что затрудняет диффузию).
Вследствие различия среднего расстояния между частицами и особенностей химической связи между ними величины коэффициентов диффузии в газах значительно выше, чем в жидкостях и твердых телах. Порядок величин коэффициентов диффузии при Т@Т0 составляет в газах (при р@р0) D @10–5 м2/с, в жидкостях D @ 10–9 м2/с, в твердых телах) D @10–14 м2/с.
Температурная зависимость коэффициента диффузии в газах определяется молекулярно-кинетической теорией и для процессов, протекающих при постоянном давлении, D(T)~ 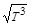 . В жидкостях и твердых телах коэффициент диффузии экспоненциально зависит от температуры:
. В жидкостях и твердых телах коэффициент диффузии экспоненциально зависит от температуры: 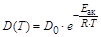 , где Еак – энергия активации диффузии. Отметим, что по величине энергия активации диффузии, как правило, в несколько раз меньше энергии активации химической реакции. Поэтому если при увеличении температуры на 10° скорость химической реакции возрастает примерно в 2-4 раза, то скорость диффузии – на 10-20%.
, где Еак – энергия активации диффузии. Отметим, что по величине энергия активации диффузии, как правило, в несколько раз меньше энергии активации химической реакции. Поэтому если при увеличении температуры на 10° скорость химической реакции возрастает примерно в 2-4 раза, то скорость диффузии – на 10-20%.
Например, в случае гетерогенной гомофазной реакции, протекающей в диффузионном режиме nА A(тв) + nВ B ® nD D (см. рис.2.11), скорость убывания веществ A и B будет определяться скоростью подвода вещества В к реакционной поверхности в результате диффузии:
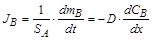 ,
, 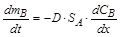 .
.
Необходимо отметить, что процессы массопереноса зависят от условий механического перемещения твердых реагентов относительно жидких и газообразных, например при перемешивании системы.
Смешанный режим. Скорости химической реакции и диффузии сравнимы по величине, поэтому общая скорость процесса будет определяться как вероятностью активных столкновений частиц, так и процессами массопереноса.
Горение и взрыв
Быстропротекающие экзотермические реакции химического превращения веществ (взрывчатые превращения) могут осуществляться в режимах горения или взрыва. При их протекании отдельные части системы имеют различную температуру и различный химический состав. Реакции, возникающие в какой-либо части системы, самоускоряются, достигают максимально возможной скорости и распространяются на всю систему.
При протекании взрывчатых превращений в системе можно выделить три области (рис.2.12): область исходных веществ, область химической реакции и область продуктов реакции. Необходимо отметить, что исходные вещества и продукты реакции можно рассматривать как системы, находящиеся в состоянии термодинамического равновесия. В относительно узкой зоне – области химических реакций – происходит инициирование процесса и собственно процесс превращения исходных веществ в продукты реакции. Эта область движется по объему вещества с большой скоростью.

Рис. 2.12. Схема развития процесса горения и взрыва: v – скорость и направление движения области химической реакции; Т1, р1 – температура и давление в области исходных веществ, Т2, р2 – в области химической реакции, Т3, р3 – в области продуктов реакции
Для того чтобы процесс был самораспространяющимся, температура исходных веществ, находящихся вблизи области химической реакции, должна достигнуть определенной величины. Это осуществляется относительно медленно в случае горения, когда температура исходных веществ повышается за счет теплопередачи от продуктов реакции. Повышение температуры исходных веществ и соответственно инициирование реакций может происходить также при распространении ударной волны (волны сжатия), которая, сжимая вещество, разогревает его. Ударная волна вызывается увеличением давления в области протекания реакции (р2) за счет роста температуры Т2 и образования большого количества газообразных продуктов.
Линейная скорость (v) движения области химических реакций при горении составляет величину @ 10-3-102 м/с, а при взрыве достигает ~ 103-104 м/с (максимальная скорость распространения ударной волны равна скорости звука в веществе).
Инициирование и развитие взрывчатого превращения, распространение области химических реакций определяются как процессами теплопередачи, так и диффузией различных веществ, содержащихся в реагирующих веществах, в промежуточных и конечных продуктах химического превращения.
Частицы промежуточных продуктов реакции могут служить активными центрами ее развития, и поэтому скорость их переноса часто оказывает решающее влияние на скорость распространения взрывчатого превращения. Особое значение эти процессы имеют при инициировании и развитии взрывчатого превращения за счет протекания цепных реакций с разветвленными цепями (цепной взрыв).
Рассмотрим условия протекания взрывчатого превращения при тепловом инициировании (тепловой взрыв). Н.Н. Семенов показал, что если в замкнутой системе протекает экзотермическая реакция, то температура вещества будет зависеть от скорости поступления тепла за счет химической реакции (теплоприход) и скорости отвода тепла в окружающую среду за счет теплопередачи (теплоотвод).
Теплоприход Q+ увеличивается экспоненциально с ростом температуры, поскольку экспоненциально растет скорость химической реакции:
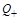 ~
~ 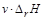 , v~
, v~ 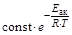 ,
, 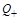 ~
~ 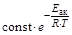 ,
,
v – скорость химической реакции; DrH < 0 – тепловой эффект реакции; Eак – энергия активации химической реакции.
Теплоотвод Q- за счет теплопередачи через поверхность площадью S линейно зависит от разности температур системы Т и окружающей среды Т0:
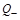 ~ a×S×(T–T0),
~ a×S×(T–T0),
a – коэффициент теплопередачи. Так как температура окружающей среды – величина постоянная (Т0-const), теплоотвод линейно увеличивается с ростом температуры.
В зависимости от природы взрывчатых веществ и условий осуществления взрывчатого превращения возможны следующие соотношения скоростей теплоприхода и теплоотвода (рис.2.13).
Если при протекании экзотермической химической реакции существует температура Тг, при которой скорость теплоотвода равна скорости прихода тепла (рис.2.13, а), то температура в системе стабилизируется и химическая реакция будет протекать с постоянной скоростью. Данное условие соответствует процессу горения. Верхняя точка соответствует состоянию неустойчивого равновесия. Случайное понижение температуры на малую величину приведет систему в состояние устойчивого равновесия за счет превышения теплоотвода. При увеличении температуры на малую величину в результате превышения теплоприхода с системе произойдет самоускорение химических реакций, переходящее во взрыв.
Рис. 2.13. Зависимости от температуры количеств тепла, выделяющихся
(теплоприхода Q+) и отводимых в единицу времени (теплоотвода Q–)
Если скорость тепловыделения больше, чем скорость теплоотвода (рис. 2.13, б) процесс химического превращения переходит во взрыв при любой температуре.
Катализ
Процесс увеличения скорости химической реакции при постоянной температуре под действием дополнительных веществ – катализаторов, не расходующихся при протекании реакции и не входящих в состав продуктов, называется катализом. Вещества, замедляющие реакции, называются ингибиторами,катализаторы биохимических реакций – ферментами.
Катализаторы, ускоряя химическую реакцию, не влияют на положение термодинамического равновесия, т. е. на константу равновесия (уменьшается только время прихода реакции в состояние равновесия, но не изменяются равновесные концентрации).
Если в системе имеется термодинамическая возможность осуществления параллельных реакций, приводящих к образованию различных продуктов, то за счет увеличения скорости одной из них при помощи катализатора можно получить преимущественный выход определенного продукта из ряда возможных.
В зависимости от того, в каких фазах находятся катализатор и реагирующие вещества, различают гомогенный и гетерогенный катализ.
Гомогенный катализ
Исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой). В ходе протекания гомогенной реакции образуется неустойчивое промежуточное соединение катализатора с реагирующими веществами, которое затем распадается с регенерацией катализатора. Роль катализатора сводится к изменению пути химического процесса, заключающегося в замене одной реакции с большей энергией активации двумя другими с меньшей (рис.2.14). Это приводит к тому, что при той же температуре процесс протекает с большей скоростью.
Пример.Реакция окисления диоксида серы кислородом протекает по уравнению
2SO2 + O2 ® 2SO3.
Добавление в систему окиси азота приводит к существенному возрастанию скорости образования триоксида серы за счет протекания процесса через две промежуточные стадии:
 |
O2 + 2NO ® 2NO2, 2SO2 + 2NO2 ® 2SO3 + 2NO.
Рис. 2.14. Энергетическая диаграмма гомогенного катализа
Дата добавления: 2020-02-05; просмотров: 960;











