Функции состояния. Работа и теплота. Первое начало термодинамики
Функциями состояния называются сложные физические величины,неподдающиеся непосредственному измерению и вычисляемые через пара-метры состояния. В технической термодинамике используются следующие функции состояния: внутренняя энергия, энтальпия, энтропия.
Параметры и функции состояния газов всегда имеют одно и то же значение в данном состоянии независимо от того, достигнуто ли оно в процессе охлаждения или нагревания, расширения или сжатия газа.
Внутренней энергиейUназывается запас энергии,которым обладаеттело в состоянии равновесия. В процессах, изучаемых технической термо-динамикой, изменение внутренней энергии происходит за счет изменения запаса внутренней тепловой энергии тела, которая представляет собой сумму кинетической энергии поступательного, вращательного и колеба-тельного движения молекул вещества и потенциальной энергии их взаимо-действия. Внутренняя кинетическая энергия зависит от температуры тела и увеличивается при ее повышении. Внутренняя потенциальная энергия за-висит от расстояния между молекулами и увеличивается при их сближе-нии, т. е. она зависит от давления и плотности. Таким образом, внутренняя энергия является функцией параметров, определяющих состояние тела. В случае идеальных газов, в которых отсутствуют силы взаимодействия молекул, изменение внутренней энергии будет обусловлено только изме-нением кинетической энергии движения молекул, т. е. для идеального газа
U=f(Т).
Энтальпия.Макроскопические тела,свойства и поведение которыхизучается термодинамикой, находятся во взаимодействии с окружающими их телами. Совокупность внутренней энергии тела и энергии внешнего взаимодействия тела с окружающей средой объединяется понятием «эн-
| тальпия». | |
| В математической записи энтальпия определяется выражением | |

где U — внутренняя энергия системы; рV — потенциальная энергия давле-ния среды на систему, выраженная в параметрах системы.
Из уравнения состояния идеального газа (2.5) произведение рV можно
| заменить на RТ, и тогда | |

|
Энтальпия идеального газа зависит только от его температуры, т. е.
I = f (Т).
Внутренняя энергия и энтальпия, отнесенные к единице массы веще-ства, называются удельными (u и i), единицей измерения которых служит Дж/кг.21
Энтропияявляется признаком обмена энергией в форме теплоты.Из-менение величины энтропии характеризует наличие теплообмена между системой и окружающей средой. При подводе теплоты к телу его энтропия возрастает, при отводе — уменьшается. Энтропия изолированной системы, находящейся в равновесии, остается неизменной.
Энтропия обозначается через S и имеет размерность Дж/К; удельная энтропия — через s, ее размерность Дж/(кг·К).
Функции состояния u, i, s являются положительными величинами. В изучаемых технической термодинамикой процессах обычно не требуется определение их абсолютных значений, а достаточно определить только изменение этих величин. Поэтому за начало отсчета для u, i, s можно при-нять любое произвольное состояние системы. В термодинамике условно принято, что значения внутренней энергии, энтальпии и энтропии при нормальных физических условиях равны нулю.
Работа,совершаемая при изменении состояния газа,вычисляется поформуле

где р — давление газа, характеризующее силу воздействия газа на окру-жающую среду, Па; V — изменение объема газа, характеризующее меха-ническое перемещение границ тела, м3.
Давление в термодинамической системе есть причина совершения ра-боты. Расширение или сжатие газа возможно только тогда, когда давление системы отличается от давления окружающей среды. Признаком соверше-ния работы служит изменение объема системы. Работа положительна, если газ расширяется, и отрицательна, если газ сжимается.
Для графического изображения работы применяется диаграмма, назы-ваемая рабочей, где количество работы измеряется площадью, расположенной над кривой изменения объема рабочего тела в процессе (рис. 2.1).
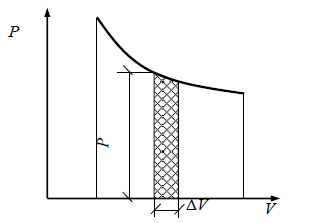
Рис. 2.1. Графическое изображение работы газа (рабочая диаграмма)
Теплота.Количество теплоты,которой система обменивается с окру-жающей средой при изменении ее состояния, определяется из выражения

где Т — температура; S — изменение энтропии системы.
Температура в процессах, сопровождающихся теплообменом, являет-ся причиной обмена энергией в форме теплоты. Обмен теплотой между те-лами возможен только при наличии разности температур.
Признаком теплообмена является изменение энтропии. Увеличение энтропии свидетельствует о подводе теплоты к системе (теплота положи-тельна), уменьшение — об отводе теплоты из системы (теплота отрица-тельна), постоянство энтропии — об отсутствии теплообмена.
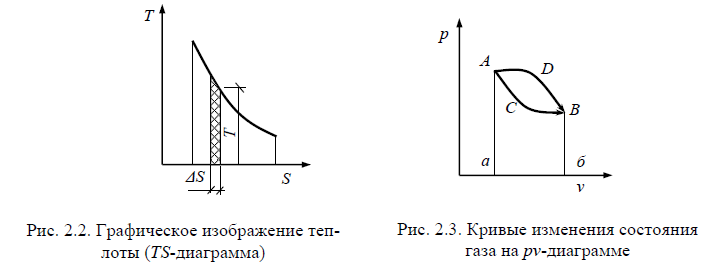
Для графического изображения количества теплоты применяется диа-грамма, называемая тепловой, где количество теплоты измеряется площа-дью под кривой изменения энтропии при изменении состояния тела (рис. 2.2). Работа и теплота, отнесенные к 1 кг газа, обозначаются строчны-ми символами соответственно l и q и измеряются в Дж/кг.
Состояние системы в pv- и TS-диаграммах изображается точкой, а процесс — кривой перехода ее из начального состояния в конечное.
На рис. 2.3 переходы системы из состояния А в состояние В осуществ-ляются различными путями: по кривой АDВ и АСВ. Площади под этими кривыми различны, следовательно, различны и количества работы и теп-лоты. В то же время начальное и конечное состояния системы в обоих процессах одинаково (точки А и В).
Таким образом, работа и теплота проявляются только в процессе из-менения состояния и зависят от характера процесса.
В термодинамической системе основную роль играет изменение внут-ренней энергии, выражающееся в количестве работы и теплоты, которыми она обменивается с окружающей средой. При этом система увеличивает свою внутреннюю энергию, если теплота подводится к ней (или над ней совершается работа) и уменьшает свою внутреннюю энергию, если она от-дает теплоту в окружающую среду (или она совершает работу над окру-жающей средой).
Это положение составляет содержание первого закона термодина-
мики:

т. е. изменение внутренней энергии системы равно разности между коли-чеством теплоты и работы, которыми система обменивается с окружающей средой.
Другими словами, вся подведенная к рабочему телу теплота расхо-
дуется на изменение внутренней энергии и на совершение работы из-менения объема:
 где Q — подводимая или обводимая теплота;
где Q — подводимая или обводимая теплота;
| U —изменение внутренней |
| энергии; L — работа изменения объема. |
Из уравнения первого начала термодинамики следует, что невозмож-но создать вечный двигатель первого рода, т. е. двигатель, который произ-водил бы работу без затрат энергии.
Единицей измерения всех видов энергии, в том числе работы и тепло-ты, служит джоуль (Дж). Количество энергии, полученное в единицу вре-мени (секунду), называют мощностью и измеряют в ваттах (Вт=Дж/с).
Дата добавления: 2016-06-15; просмотров: 7155;











