Термодинамические процессы
В технической термодинамике изучаются процессы, в которых в каче-стве рабочего тела применяется идеальный газ. Задачей исследования тер-модинамических процессов является определение закономерностей изме-нения состояния (уравнение процесса), вычисление изменения функций состояния, количества работы и теплоты.
В технической термодинамике рассматриваются следующие основные процессы (рис. 2.4).
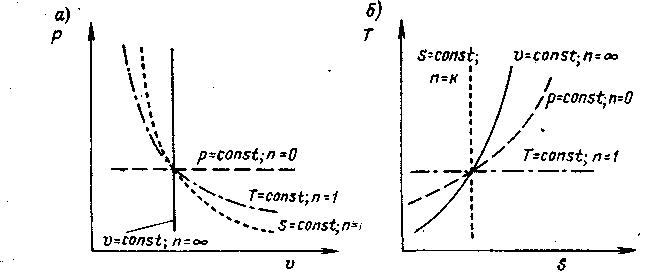
Рис. 2.4. Основные термодинамические процессы: а — на pv-диаграмме; б — на TS-диаграмме
1. Изохорный процесс (v = const). В этом процессе теплота, подведен-ная к рабочему телу, полностью идет на приращение его внутренней энер-гии, т. е. работа процесса равна нулю. В изохорном процессе отношение давлений в начале и конце процесса равно отношению абсолютных темпе-ратур в тех же состояниях.
2. Изобарный процесс (р = const). В этом процессе теплота, подведен-ная к рабочему телу, расходуется на изменение его внутренней энергии и на совершение работы. Количество теплоты в изобарном процессе равно приращению энтальпии рабочего тела. Отношение объемов в начале и конце процесса равно отношению абсолютных температур тела в тех же состояниях.
3. Изотермический процесс (Т = const). В этом процессе энтальпия и внутренняя энергия рабочего тела остаются постоянными. Количество те-плоты в соответствии с первым законом термодинамики равно количеству
работы. Изменение давления в процессе обратно пропорционально изме-нению объема рабочего тела.
4. Адиабатный процесс (s = const). В этом процессе отсутствует теп-лообмен с окружающей средой. Работа в адиабатном процессе совершает-ся за счет изменения внутренней энергии рабочего тела. При этом изменя-ется значение всех параметров состояния, связанных между собой степен-ными функциями при помощи показателя адиабаты:

Перечисленные выше четыре процесса можно рассматривать как ча-стные случаи общего политропного процесса, уравнение которого имеет вид

где n — показатель политропы.
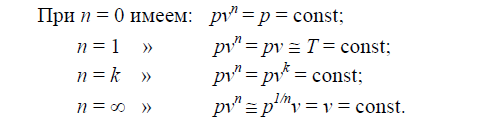
В политропном процессе остается постоянной теплоемкость, вычисляется по формуле

В отличие от сv и ср, являющихся положительными величинами, теп-лоемкость в различных политропных процессах может иметь любое значение от + до – .
Дата добавления: 2016-06-15; просмотров: 3543;











