Основные параметры состояния термодинамических систем
Термодинамической системой называется совокупность различныхтел, способных энергетически взаимодействовать между собой и окру-жающей средой. При этом количество вещества может быть постоянным или переменным, а тела могут находиться в различных агрегатных состоя-ниях (газообразном, жидком или твердом).
Под окружающей средой понимается совокупность всех остальных тел, не вошедших в термодинамическую систему.
Термодинамическая система называется изолированной, если она не взаимодействует с окружающей средой, закрытой — если это взаимодейст-вие происходит только в форме обмена энергией, и открытой — если она обменивается с окружающей средой как энергией, так и веществом. Измене-ние состояния термодинамической системы в результате обмена энергией с окружающей средой называется термодинамическим процессом.
Основными параметрами, которыми характеризуются процессы вза-имного превращения работы и теплоты, являются температура Т, давление р и объем V.
Температураявляется мерой интенсивности движения молекул ве-щества. Чем больше кинетическая энергия движения молекул, тем выше температура. Температура, соответствующая состоянию полного покоя молекул газа, принята за абсолютный нуль. Эта точка является началом от-
счета температуры по абсолютной шкале Кельвина (обозначение — Т, К). В технике обычно используется стоградусная шкала температур Цельсия (обозначение — t, °С), в которой за 0 °С принята точка плавления льда, а за 100 градусов — постоянная точка кипения воды при нормальном атмо-сферном давлении.
Пересчет температуры из стоградусной шкалы в абсолютную произ-водится по формуле
Т = t +273,15К, (2.2)
при этом по размеру градус Цельсия равен кельвину: 1 °С = 1 К, т. е.
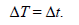
Температура определяет направление перехода теплоты, выступает как мера нагретости тел. Две системы, находящиеся между собой в тепло-вом равновесии, имеют одинаковые температуры.
Давление газа.Согласно кинетической теории,газ,находящийся взакрытом сосуде, оказывает на его стенки давление, которое является ре-зультатом силового воздействия молекул газа, находящихся в беспорядоч-ном движении. Давление определяется как сила, действующая на единицу поверхности, и измеряется в паскалях (Па = Н/м2).
Сумма барометрического (атмосферного) и избыточного давления, оказываемого газом на стенки сосуда, составляет абсолютное давление:
| рАБС = рБ + рИЗБ. | (2.3) |
Удельный объем.Газ является однородным веществом,т.е.в каждойединице его содержится одинаковое количество вещества. Удельным объемом газа v,м3/кг,называется объем единицы его массы,определяемый
| по формуле | |
| v=V/М, | (2.4) |
где V — объем, занимаемый газом, м3; М — масса газа в объеме V, кг. Количество вещества, содержащееся в единице объема, называют
плотностью газа ρ, кг/м3. Она является обратной величиной по отношению к удельному объему.
Состояние термодинамической системы, характеризуемое постоян-ным во времени и во всей массе системы значением параметров, называет-ся равновесным. В системе, находящейся в термодинамическом равнове-сии, отсутствует всякий поток тепла и вещества как внутри системы, так и между системой и окружающей средой. Равновесное состояние газа можно выразить уравнением f (р, V, T) = 0.
Идеальным газом называется газ,состоящий из молекул,размерамикоторых можно пренебречь и которые не взаимодействуют между собой (отсутствует потенциальная энергия взаимодействия). Введение понятия идеального газа в термодинамике позволяет получить более простые ана-литические зависимости между параметрами состояния. Опыт показывает, что с известным приближением эти зависимости могут быть применены для изучения свойств реальных газов.
Дата добавления: 2016-06-15; просмотров: 4308;











