Термодинамические циклы. Второй закон термодинамики
Термодинамическим циклом,или круговым процессом,называют про-
цесс, при котором рабочее тело после ряда последовательных изменений возвращается в исходное состояние. В рабочей и тепловой диаграммах та-кой цикл изображается замкнутой линией (рис. 2.5). Круговые процессы лежат в основе действия тепловых двигателей и холодильных установок всех видов.
Рассмотрим круговой процесс, изображенный на рабочей диаграмме. Работа на участке цикла ABC положительна (объем тела увеличивается), а
на участке СDА — отрицательна (объем тела уменьшается). Но их разность положительна, следовательно, результирующая работа также положитель-на. Она равна площади замкнутой линии АВСDА.
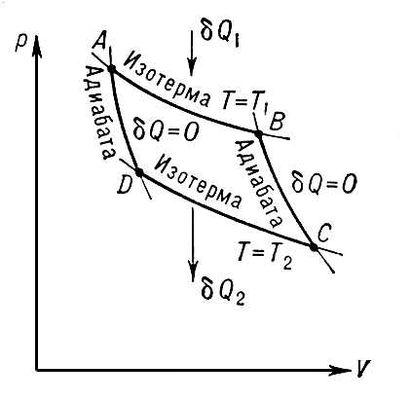
Рис. 2.5. Прямой круговой процесс на диаграмме рv
На основании первого закона термодинамики для кругового процесса можно написать

Так как в цикле конечное состояние рабочего тела совпадает с начальным, то есть u2–u1, то

где lц — работа, совершаемая в цикле.
В рассмотренном примере lц>0, поэтому и q1>q2. Это означает, что на тепловой диаграмме линия подвода теплоты АВС должна лежать выше ли-нии отвода СDА. При этом линии АВС будет соответствовать более высо-кая температура окружающей среды, чем линии СDА, т. е. Т1>Т2.
В результате совершения цикла часть теплоты, полученной рабочим телом, была отдана окружающей среде в виде работы.
Круговые процессы, в которых рабочее тело, получая теплоту от ис-точника, совершает механическую работу, называются прямыми, или цик-лами тепловых двигателей.
Последовательность процессов в цикле может быть и такой, когда расширение рабочего тела происходит при более низком давлении, чем его сжатие. В этом случае результирующая работа будет отрицательной (l2>l1).
В соответствии с первым законом термодинамики теплота цикла так-же должна быть отрицательной (q2>q1), что будет иметь место, если на
участке ABС теплота отводится, а на участке СDА теплота подводится к рабочему телу (рис. 2.6). На тепловой диаграмме линия АВС будет лежать выше линии СDА, то есть Т2 >Т1. Таким образом, в цикле осуществляется перенос теплоты от тела с меньшей температурой к телу с большей тем-пературой.
Круговые процессы, в которых происходит перенос теплоты от хо-лодного тела к нагретому за счет затраты работы, называются обратными, или циклами холодильных установок.
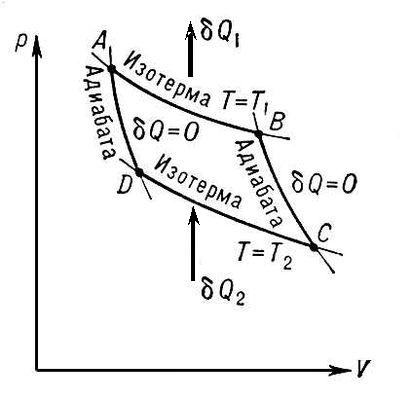
Рис. 2.6. Обратный круговой процесс на диаграммах рv и TS
Цикл Карно.Исследования прямого цикла показали,что не вся под-веденная от источника к рабочему телу теплота может быть превращена в работу, а только часть ее. Остальное количество теплоты неизбежно отво-дится в холодный источник.
Отношение количества теплоты, превращенной в работу за цикл, к те-плоте, подведенной к рабочему телу, называется термическим коэффици-
ентом полезного действия цикла:

Возникает практический вопрос, в каком круговом процессе (цикле) при заданных температурах источника теплоты и приемника (холодильника) можно получить максимальную полезную работу. В термодинамике доказы-вается, что таким циклом является круговой процесс, предложенный Сади Карно. Этот цикл состоит из двух изотерм и двух адиабат (рис. 2.7).
На тепловой диаграмме цикл Карно изображается прямоугольником 12341 (рис. 2.7, б); коэффициент полезного действия цикла равен

где Т1 — температура источника теплоты, К; Т2 — температура приемника теплоты, К.
Коэффициент полезного действия цикла Карно зависит только от тем-ператур источника и приемника, при которых соответственно подводится и отводится теплота к рабочему телу, но не зависит от природы рабочего тела и его физических свойств. Коэффициент полезного действия цикла Карно при Т1= Т2 равен нулю, что указывает на невозможность превраще-ния теплоты в работу, если все тела окружающей среды имеют одинако-вую температуру. Коэффициент полезного действия цикла Карно не может равняться единице, так как в природе не существует источника теплоты с бесконечно высокой температурой или же приемника теплоты с темпера-турой, равной абсолютному нулю, т. е. Т2/ Т1 >0.
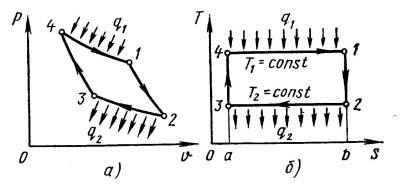
Рис. 2.7. Цикл Карно на диаграммах рv (а) и TS (б)
Изучение термодинамических циклов приводит к важнейшим выво-дам о направлениях протекания процессов превращения работы и теплоты, о неравноценности теплоты и работы.
Первый закон термодинамики устанавливает количественное соотно-шение между теплотой, работой и изменением внутренней энергии тела, но он не определяет направления течения процессов.
Направление течения процессов, происходящих в природе, устанав-ливает второй закон термодинамики. Согласно Клаузиусу, давшему одну из первых формулировок второго закона термодинамики, «теплота не может сама собой переходить от менее нагретого тела к более нагретому».
Превращение теплоты в работу возможно только при передаче ее из горячего источника в холодный, осуществляемой при посредничестве ра-бочего тела, и происходит до тех пор, пока существует разность темпера-тур между этими источниками.
Превращение работы в теплоту происходит без всяких ограничений, самопроизвольно.
Теплота может переходить самопроизвольно лишь от более нагретого тела к телу с меньшей температурой, но обратный переход теплоты от хо-лодного тела к горячему требует затраты внешней работы.
Эти положения показывают основную сущность второго закона тер-модинамики, определяющего условия, при которых возможно превраще-ние теплоты в работу, и те факторы, от которых зависит эффективность этого превращения.
Второй закон термодинамики требует четкого разграничения понятий обратимых и необратимых процессов.
Процессы называются обратимыми, если они могут протекать как в прямом, так и в обратном направлении, причем система при обратном процессе последовательно проходит через те же состояния, через которые она проходила в прямом направлении. Условием осуществления обрати-мых процессов является бесконечное их медленное протекание, при кото-ром нельзя обнаружить обмена энергией между системой и окружающей средой, т. е. когда процесс представляет собой совокупность после-довательных бесконечно мало отличающихся от равновесия состояний.
Необратимым называется процесс,после которого система и взаимо-действующая с ней окружающая среда не могут возвратиться в исходное состояние. Все реальные процессы являются необратимыми (неравновес-ными). Работу можно совершить, если имеется разность давлений между системой и окружающей средой, также и теплота может переходить при наличии только разности температур между телами. В этих процессах сис-тема не может находиться в состоянии равновесия, следовательно, они яв-ляются необратимыми. Необратимость реальных явлений указывает на од-нонаправленность всех естественных процессов. Во всех необратимых процессах наблюдается самопроизвольный переход энергии любого вида в тепловую форму, что приводит к увеличению энтропии изолированной системы.
Энтропия всякой изолированной совершающей работу системы нико-гда не уменьшается, она остается постоянной при обратимых процессах и всегда возрастает при необратимых процессах.
Принцип необратимости, или принцип возрастания энтропии, являет-ся общей формулировкой второго закона термодинамики.
Вопросы для самоконтроля
1. Предмет технической термодинамики.
2. Каковы основные параметры состояния термодинамических систем?
3. Напишите и объясните физический смысл уравнения состояния иде-ального газа.
4. Поясните физический смысл теплоемкости.
5. Первый закон термодинамики.
6. Какие термодинамические процессы вам известны?
7. Второй закон термодинамики.
Дата добавления: 2016-06-15; просмотров: 6155;











