Примеры решения задач. Вычислить рН 0,25%-ного раствора аммиака
1. Вычислить рН 0,25%-ного раствора аммиака. Ki(NH3·Н2О) = 1,74·10 –5.
Решение:
Раствор аммиака в воде является слабым основанием, ионизирующим по уравнению:
NH3 ·H2O 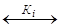 NH4++OH–
NH4++OH–
Ki= 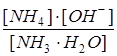 , откуда [OH–]=[NH4+]=
, откуда [OH–]=[NH4+]= 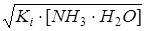 .
.
Пусть объем раствора Vр-ра=1 л, его плотность d=1 г/мл. Тогда в 1 л раствора содержится:
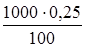 =2,5 г NH3, откуда
=2,5 г NH3, откуда
СNH 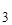 =[NH3·H2O]=
=[NH3·H2O]= 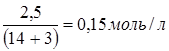 .
.
[OH–] = 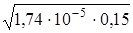 =1,60·10–3 моль/л.
=1,60·10–3 моль/л.
рОН = – lg[OH–] = –lg(1,60·10–3)=2,80.
рН =14,0–рОН = 14,0–2,80=11,2.
Ответ: рН р-ра NH3 = 11,2.
2. Вычислить произведение растворимости SP Fe(OH)3, если
растворимость его в воде SFe(OH) 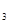 =2·10-3 г/дм3.
=2·10-3 г/дм3.
Решение:
Гидроксид железа (III) ионизирует по уравнению: Fe(OH)3↔Fe3++3OH–
Выражение произведения растворимости для него:
SPFe(OH) 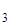 =[Fe3+]·[OH–]3.
=[Fe3+]·[OH–]3.
Можно показать, что растворимость S и произведение растворимости SP связаны выражением SP=(nn·mm)·S(n+m), где n, m ‑ число катионов и анионов соответственно:
SP=(11·33)·S(1+3)=27S4.
В приведенных формулах концентрации должны быть в молях на литр, поэтому:
S=2·10–8г/л= 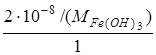 =
= 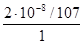 =1,87·10–10 моль/л,
=1,87·10–10 моль/л,
SP=27·(1,87·10–10)4=3,30·10–38 (моль/л)4.
Ответ: SPFe(OH) 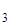 =3,30·10–38 (моль/л)4.
=3,30·10–38 (моль/л)4.
Литература
1. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2006, 460 с.
2. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
3. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с.
4. Цитович И.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с.
5. Васильев В.П. Аналитическая химия. - М.: высшая школа, 1989, Т. 1, 384 с.
6. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с.
7. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с.
8. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
Глава 3. Количественный химический анализ
Количественный анализ – совокупность методов (теоретических и практических) определения абсолютного или относительного содержания химических элементов в веществах и (или) веществ в смесях.
Оптические методы.Основаны на исследовании спектров поглощения, излучения и рассеяния веществ.
1. Фотометрический – изучение поглощения окрашенными веществами в видимой и УФ областях.
2. Нефелометрический – измерение рассеяния света коллоидными системами.
3. Эмиссионный спектральный – изучение спектров излучения (эмиссии) возбужденных атомов.
4. Фотометрия пламени – измерение интенсивности излучения при возбуждении пламенем с помощью фотоэлементов; чувствительность 10-3 г.
5. Люминесцентный – измерение люминесценции (свечения) при возбуждении УФ. Интенсивность свечения ~ концентрации. Чувствительность 10-8÷-10 г.
6. Рентгеноспектральный – исследование вещества с помощью рентгеновских (Х) лучей по:
- характеристическому рентгеновскому излучению;
- анализу энергии испускаемых электронов – электронная спектроскопия.
Таблица 6
Методы количественного анализа
| Химические | Физические | Физико-химические | |||
| Гравиметрический (весовой) | Титриметрический (объемный) | Газовый | Используют взаимозависимость физических и химических свойств (например, концентрация раствора кислоты и плотность ее растворов) Определение состава вещества, не прибегая к химическим превращениям | Химические реакции, сопровождающиеся изменением физических свойств (например, электропроводимости, интенсивности окраски) | |
| - составная часть выделяется в виде осадка, масса которого определяется - убыль массы при нагреве - летучий компонент улавливается поглотителем, и определяют его массу | Измеряют объемы растворов, концентрация одного из которых известна – титрованный раствор | Определяют объемы газообразных веществ, обычно после поглощения сорбентами | |||
| Делятся на: 1. Оптические 2. Электрохимические 3. Хроматографические 4. Радиометрические | |||||
Электрохимические методы:
1. Электрогравиметрический. Электролиз с выделением веществ на электродах и их взвешивание (метод внутреннего электролиза здесь же).
2. Электротитриметрический (объемный). Эквивалентную точку определяют по изменению некоторых электрических свойств раствора.
3. Потенциометрический. Измеряют потенциал электрода.
4. Кондуктометрический. Измеряют электропроводимость системы.
5. Кулонометрический. Определяют количество электричества, идущего на окисление или восстановление вещества.
6. Вольтамперометрический. Изучают зависимость ток ‑ потенциал. Полярографический. Определяют величину диффузионного тока, пропорциональную концентрации вещества.
Масс-спектральный метод. Основан на разделении потока ионов в электрическом и магнитном поле в зависимости от отношения их массы к заряду. Чувствительность до 10–15 г.
Хроматографический метод.Основан на разделении смеси растворенных веществ, смеси газов, паров жидкостей сорбционным методом в динамических условиях. Существует жидкостная (колоночная, бумажная, тонкослойная), газо-жидкостная, газовая хроматография.
Радиометрический метод.Основан на измерении счетчиками Гейгера-Мюллера интенсивности излучения в единицу времени радиоактивных элементов, входящих в вещество. Чувствительность до 10–11 г.
Дата добавления: 2022-02-05; просмотров: 1091;











