Влияние состава на степень связности кремнекислородных тетраэдров
Количество нестеклообразующих оксидов МеnOm определяет соотношение мостиковых и немостиковых атомов кислорода. Свойства кремнекислородных тетраэдров SiO4 в структуре стекла в первую очередь зависят от степени связности, т.е. от числа связей с соседними тетраэдрами.
Мерой степени связности служит структурный коэффициент fSi, равный отношению количества атомов кремния к количеству атомов кислорода – fSi = [Si]/[O]. Коэффициент fSi максимален для кварцевого стекла SiO2 и составляет 0,5. В общем случае для силикатов, содержащих различные оксиды, коэффициент fSiопределяют по формуле:
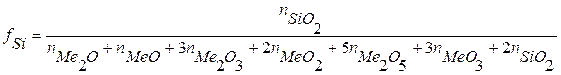
Другой характеристикой является кислородное число:
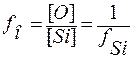 .
.
Обозначим через y число общих вершин у кремнекислородного тетраэдра.
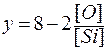 ;
; 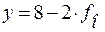 .
.
В этих уравнениях 8 – число валентных связей у четырёх атомов кислорода в кремнекислородном тетраэдре.
Вторая часть уравнения – это количество валентных связей атомов кислорода, остающихся у тетраэдра (замыкающихся на центральный катион кремния и катионы-модификаторы).
Рассмотрим на нескольких примерах, как меняется степень связности кремнекислородного каркаса стекла при введении в кремнезём модификаторов.
1. SiO2; fSi = 1/2 = 0,5; fо = 2; у = 8 - 2∙2 = 4.
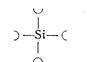
Тип кремнекислородного радикала:
Радикал [SiO2]∞∞∞ или правильнее [SiO4/2]∞∞∞ – повторяется непрерывно в трёх измерениях. Все вершины тетраэдров – мостиковые.
 Тип структуры в кристаллах – геометрически правильная трехмерная сетка, в кварцевом стекле – беспорядочная трёхмерная сетка из тетраэдров SiO4. Кристаллические силикаты – каркасные.
Тип структуры в кристаллах – геометрически правильная трехмерная сетка, в кварцевом стекле – беспорядочная трёхмерная сетка из тетраэдров SiO4. Кристаллические силикаты – каркасные.
2. Me2O∙2SiO2; MeO∙2SiO2 – бисиликаты или дисиликаты.
fSi= 2/5 = 0,4; fо = 5/2 = 2,5; y = 8 - 2∙2,5 = 3;
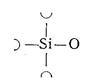
Радикал имеет вид:
Из четырёх атомов кислорода три атома
остались мостиковыми, отрицательный заряд одного
аниона кислорода компенсируется катионом-модификатором.
Сетка непрерывна в двух измерениях и состоит из кремнекислородных радикалов:
[SiO2,5]∞∞; [SiO3/2О1/1]∞∞.
Тип структуры – двухмерная сетка. Кристаллические силикаты – слоистые. Пример – слюда. Тип структуры в стекле – искривленная двухмерная сетка. По содержанию диоксида кремния рассмотренный случай соответствует обычному силикатному стеклу. О характере пространственного расположения двухмерной сетки тетраэдров SiO4 в стекле можно судить по характерному раковистому излому стеклянного стержня.
3. Me2O∙SiO2; MeO∙SiO2 – метасиликаты (ит. meta – половина).
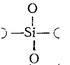
fSi= 1/3; fо = 3; у = 8 - 2∙3 = 2
Две кислородные вершины общие.
Кремнекислородный радикал имеет вид:
[SiO3]∞ или [SiO2/2О2/1]∞,
повторяется непрерывно в одном измерении. В тетраэдре SiO4 только два атома кислорода – мостиковые.
Тип структуры – кольца, цепи (трёх- или шестичленные кольца). Кристаллические силикаты – цепочечные (волокнистые), кольцевые. Пример – асбест. Так как в силикате сохраняется бесконечность структуры из тетраэдров SiO4, данный состав также стеклуется без затруднений. Протяжённые цепочки связанных тетраэдров фиксируют структуру силиката при охлаждении расплава.
4. 3Me2O∙2SiO2; 3MeO∙2SiO2 – пиросиликаты (гр. pyr – огонь) или диортосиликаты (гр. di…– двойной, orthos – правильный).
fSi= 2/7; fо = 3,5; у = 8 - 2∙3,5 = 1
Возникают изолированные группы из сдвоенных тетраэдров или диортогруппы.
[Si2O7]6-
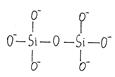
Тип структуры – сдвоенные тетраэдры. Кристаллические силикаты – фрагментарные.
Пример: ранкинит Ca3[Si2O7].
Расплав при охлаждении кристаллизуется достаточно легко, стеклование маловероятно, так как отсутствует непрерывная сетка из кремнекислородных тетраэдров. Изолированные диортогруппы относительно подвижны и перестраиваются в кристаллическую структуру, обладающую минимальной энергией.
5. 2Me2O∙SiO2; 2MeO∙SiO2 – ортосиликаты.
fSi = 1/4 = 0,25; fо = 4; у = 8 - 2∙4 = 0.
Получаем дискретные тетраэдры SiO4
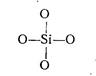
Тип структуры – отдельные тетраэдры. Кристаллические силикаты – островные. При обычных условиях охлаждения расплав легко кристаллизуется из-за высокой подвижности кремнекислородных тетраэдров, окружённых катионами-модификаторами.
Только в первых трёх примерах составов силикатов формируется непрерывная бесконечная структура из кремнекислородных тетраэдров, характерная для стеклообразного состояния. Стекло образуется, если содержание диоксида кремния составляет не менее 50 мол.%. Число общих вершин должно быть больше или равно двум (у≥2).
Использование степени связности позволяет объяснить различные свойства стёкол. Так как связи в стекле неравноценные, то с повышением температуры начинают рваться самые слабые связи. Поэтому у стекла отсутствует температура плавления, а есть интервал размягчения.
С увеличением содержания модификаторов растет число разорванных связей в сетке стекла. Растёт подвижность частиц, увеличивается электропроводность, снижается вязкость, меняются и другие свойства.
Для определения числа общих вершин кремнекислородных тетраэдров можно использовать и мольное содержание диоксида кремния SiO2:
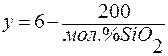 ,
,
y – число общих вершин.
Если мол.% SiO2 = 100, то у максимально и равно 4;
Если мол.% SiO2 = 50, то у = 2;
В некоторых случаях стёкла образуются при концентрации SiO2 меньше 50 мол.% или при у < 2. Стёкла, содержащие менее 50 мол.% диоксида кремния называются инвертными. Стеклообразование в инвертных стёклах обусловлено:
1. Изоморфизмом – способностью элементов замещать кремний в кремнекислородной сетке. Изоморфизмом обладают катионы Al3+, B3+, Te3+ Тi3+ и некоторые другие;
2. Поляризацией крупных катионов под воздействием анионов кислорода. Самой высокой поляризационной способностью обладает катион свинца Pb2+:
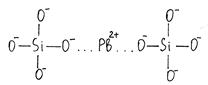
Катион Pb2+ большого размера деформируется, и возникает направленная связь, наподобие ковалентной. Характерный пример инвертных стёкол – оптические стекла типа флинтов с повышенным содержанием оксидов свинца.
Дата добавления: 2018-11-26; просмотров: 1146;











