Механизм процесса адсорбции
Адсорбцией называется концентрирование вещества в поверхностном слое в результате его самопроизвольного перехода из объема фазы.
Процесс адсорбции обычно наблюдается в 2-х фазных системах:
· Газ – твердое;
· Жидкость - твердое.
Равновесие в процессе адсорбции определяется двумя процессами:
1. Притяжением молекул (ионов) к поверхности раздела фаз под действием межмолекулярных сил.
2. Тепловым движением, стремящимся восстановить равенство концентраций в поверхностном слое и объеме фазы.
Количественно процесс адсорбции характеризуется числом молей или массой вещества, накапливающегося на границе раздела фаз в расчете на единицу площади или объема твердой фазы.
Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра. Эта теория позволяет учесть ограниченность адсорбционного объема или поверхности адсорбента по поглощаемому веществу. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества.
Это положение является основным в теории Ленгмюра и уточняется следующими допущениями:
1) адсорбция локализована (молекулы не перемещаются по поверхности) на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбата - образуется мономолекулярный слой;
2) адсорбционные центры энергетически эквивалентны - поверхность адсорбента эквипотенциальна;
3) адсорбированные молекулы не взаимодействуют друг с другом.
Для получения уравнения изотермы обратимся к основному положению теории Ленгмюра. Примем, что при адсорбции происходит квазихимическая реакция между распределяемым компонентом и адсорбционными центрами поверхности:
А* + В ↔АВ*

где А* - адсорбционные центры на поверхности адсорбента;
В – адсорбируемые молекулы;
АВ* - образующийся на поверхности комплекс.
По мере увеличения концентрации вещества В реакция сдвигается в сторону образования комплекса и свободных адсорбционных центров становится меньше. Константа адсорбционного равновесия (без учета коэффициентов активности реагирующих веществ) равна:
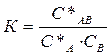 (1)
(1)
В этом соотношении
С*АВ=А и С*А =А∞ - А, (2)
где А – величина адсорбции (количество поглощенного вещества на единице поверхности или массы адсорбента);
А∞ - максимальная емкость адсорбционного слоя.
Подставляя уравнение (2) в уравнение (1), получим:
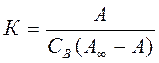
или
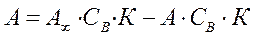
После преобразований:
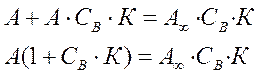
окончательно получим
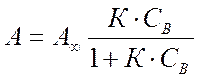 (3)
(3)
Выражение (3) называется уравнением изотермы адсорбции Ленгмюра. Так как концентрации газов и паров практически пропорциональны парциальным давлениям, то для них изотерма адсорбции Ленгмюра принимает вид:
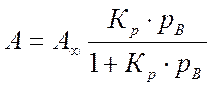 , (4)
, (4)
где РВ – парциальное давление вещества В в газовой смеси.
Необходимо отметить, что константа адсорбционного равновесия в уравнении Ленгмюра (К и КР) характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия.
Важны экстраполяционные следствия из соотношений (3) и (4). При малых концентрациях или давлениях, когда СВ ® 0, получаем:
К×СВ ®0 и А = А¥×К×СВ
Величина адсорбции линейно растет с увеличением концентрации.
При больших концентрациях и давлениях, когда К×СВ >>1 и Кр×рВ >>1, уравнения (3) и (4) переходят в соотношение:
А = А¥ (5)
Соотношения (5) отвечают насыщению, когда вся поверхность адсорбента покрывается мономолекулярным слоем адсорбата.
При адсорбции газов из их смесей в соответствии с уравнением изотермы Ленгмюра величины адсорбции суммируются, а концентрация свободных центров является общей для равновесной многокомпонентной системы.
В этом случае изотерма адсорбции для i –го компонента запишется следующим образом:
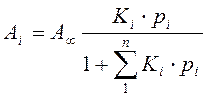 (6)
(6)
Из уравнения (6) следует, что увеличение парциального давления одного компонента подавляет адсорбцию других, и тем сильнее, чем больше его адсорбционная константа равновесия.
Уравнение Ленгмюра можно использовать только при отсутствии адсорбции вещества сверх мономолекулярного слоя. Это условие выполняется достаточно строго при хемосорбции, физической адсорбции газов при небольших давлениях и температурах выше критической (при отсутствии конденсации на поверхности адсорбента), а часто и при адсорбции из растворов.
В большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и поэтому остается возможность влияния поверхностных сил на второй, третий и последующие адсорбционные слои. Эта возможность реализуется, когда газы и пары адсорбируются при температурах ниже критической, т. е. образуются полимолекулярные слои вещества на поверхности адсорбента, что можно представить как вынужденную конденсацию пара под действий поверхностных сил. В результате если в области образования мономолекулярного слоя величина адсорбции существенно замедляет свой рост с увеличением давления пара, то в области давлений, близкой к давлению насыщенного пара, она резко начинает возрастать и адсорбция заканчивается объемной конденсацией пара при p = ps (ps-давление насыщенного пара).
Современная же форма уравнения полимолекулярной адсорбции — основного уравнения обобщенной теории Ленгмюра — была предложена лишь примерно двадцать лет спустя Брунауэром, Эмметом и Теллером. В соответствии с начальными буквами фамилий авторов обсуждаемая теория получила название теории БЭТ.
В этой теории дополнительным допущением к тем, которые были положены в основу вывода уравнения изотермы Ленгмюра, является представление об образовании на поверхности адсорбента «последовательных комплексов» адсорбционных центров с одной, двумя, тремя и так далее молекулами адсорбата.
Согласно теории БЭТ изотерма полимолекулярной адсорбции описывается уравнением:
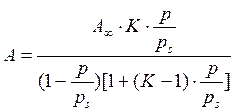 ,
,
где К – постоянная, равная отношению констант адсорбции и конденсации пара (константа конденсации пара величина обратная давлению насыщенного пара).
К=Кр×рs
При уменьшении парциального давления р/рs<<1
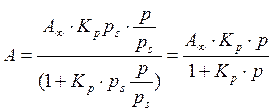
изотерма полимолекулярной адсорбции превращается изотерму Лэнгмюра (мономолекулярная адсорбция).
Дата добавления: 2021-11-16; просмотров: 660;











