Химическое равновесие
Согласно закону действия масс, направление химической реакции зависит от концентрации реагирующих веществ и продуктов реакции. Химическая система считается равновесной, если скорости протекания прямой и обратной реакции равны.
Рассмотрим реакцию:
bB + cC = dD + eE
где B, C - реагирующие вещества;
D, E - продукты реакции;
b,c,d,e - число молей (стехиометрические коэффициенты).
Скорость прямой реакции, согласно закону действия масс:
V 1 = k1 *[B]b * [C]c
обратной
V 2 = k2 *[D] d *[E] e
где [B],[C],[D],[E] - концентрации веществ;
k1,k 2 - соответственно коэффициенты скорости прямой и обратной реакции.
Отношение
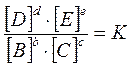
называется термодинимической константой равновесия (К).
Стандартная свободная энергия реакции связана с константой равновесия К равенством:
DGреакции = - R×T×lnK
При значении универсальной газовой постоянной R = 0,008314 Дж/моль ×К, Т = 298.15оК :
DGреакции = - 5,7 lgK
Из этого соотношения понятно, что DGреакции < 0 возможно лишь при К >> 0, т.е. когда равновесие реакции смещено в сторону образования продуктов реакции.
Для окислительно-востановительных реакций стандартная свободная энергия реакции определяется соотношением:
DGреакции = n ×E0 ×F
где n - число участвующих в реакции электронов;
Е0 - стандартный окислительный потенциал реакции (при концентрации реагирующих веществ 1 М);
F - число Фарадея, кДж/в г-экв (F = 96,39 кДж/в г-экв).
Для условий отличающихся от стандартных, окислительный потенциал реакции (Еh) определяется уравнением Нернста:
Eh = E0 + R×T×lnK/n×F
После подстановки значений постоянных величин R,T,F:
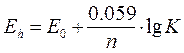
Данные соотношения позволяют по величине DGреакции вычислить К и определить состояние системы в стадии равновесия.
Рассмотрим методику определения условий очистки сточных вод от ионов токсичных металлов при осаждении их в виде гидроксидов.
В качестве критерия при определении граничных условий рН примем значения ПДК для рыбохозяйственных и хозяйственно – питьевых водоемов.
Рассмотри в качестве примера определение условий осаждения гидроксида кадмияz Cd(OH)2. ПДК для ионов кадмия в водоемах рыбохозяйственной категории – 0,001 мг/л, в водоемах хозяйственно-питьевых – 0.005 мг/л.
Реакция растворения Cd(OH)2. описывается уравнением:
Cd(OH)2 +2H+ Û Cd2+ + 2H2O
Константа скорости реакции:
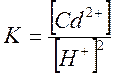
Прологарифмируем данное уравнение и после преобразования получим:
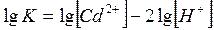
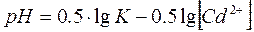
Значение lgK определяется из соотношения:
DFoреакции = - 5,7 lgK
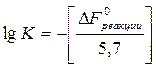
DFoреакции =(DFoобр.(Cd2+) + 2DFoобр.(H2O)) - (2DFoобр.(H+) + +DFoобр.(Cd(OH)2)) =
= (-77,74- 2*-236,94) – (2*0 - 473,8) = -77,82 кДж/моль
Тогда lgK = 13,65
Для вычисления величины рН, при которой растворение Cd(OH)2 приведет к созданию концентраций иона Cd2+ на уровне ПДК пересчитаем мг/л в г-ион/л:
[Cd2+]=ПДК/(1000*112.4), где 112.4 – атомная масса Cd
[Fe2+]рх =0,001/(1000*112.4)= 8.9×10-9 г-ион/л
[Fe2+]хп =0,005/(1000*112.4)= 4.45×10-8 г-ион/л
Тогда граничные условия по величине рН будут:
Для ПДКрх рН=10.85; для ПДКхп рН=10.5.
Таким образом, граничные условия по рН для гидроксида кадмия лежат в сильнощелочной области.
Дата добавления: 2021-11-16; просмотров: 562;











