Скорость процесса адсорбции
Процесс адсорбции в одних случаях может протекать очень быстро, в других - сравнительно медленно. Под кинетикой процесса адсорбции понимается изменение величины адсорбции А со временем τ:
A=f(τ) dA/dτ=f’(τ)
Производная характеризует скорость адсорбции. Эти уравнения называют уравнениями кинетической кривой в интегральной и дифференциальной форме.
Скорость адсорбции на однородной поверхности с образованием мономолекулярного слоя (ленгмюровская адсорбция) складывается из скоростей двух противоположных процессов. Скорость прямого процесса определяется скоростью закрепления молекул адсорбата на поверхности адсорбента V1, а обратного — скоростью удаления молекул с поверхности V 2.
Первая скорость пропорциональна числу столкновений молекул адсорбата ν1 с единицей поверхности адсорбента, доле свободной поверхности (1—θ) и доле молекул α, способных к закреплению на поверхности.
Скорость обратного процесса (десорбции) пропорциональна числу уходящих молекул ν2 с единицы площади насыщенной поверхности и степени заполнения поверхности θ. В результате скорость адсорбции выразится суммарным уравнением:
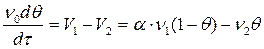 (7)
(7)

где ν0 – количество активных на единице поверхности адсорбента.
После решения дифференциального уравнения получаем:
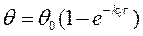 или
или 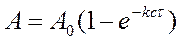
где кс – константа скорости адсорбции.
Рассмотрим, от каких факторов зависит константа скорости адсорбции Кс. Для Кс может быть записано следующее выражение, вытекающее из уравнения (7):
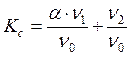 , (8)
, (8)
т.е. Кс пропорциональна скоростям процессов адсорбции и десорбции.
Число столкновений молекул адсорбата ν1 с единицей поверхности адсорбента может быть определена с помощью выражения из молекулярно-кинетической теории:

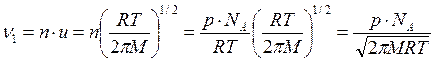 ,
,
где n – число молекул в единице объема;
u – средняя скорость молекул в заданном направлении (из фазы к границе раздела);
M – молекулярная масса;
NA – число Авогадро;
R – универсальная газовая постоянная;
T – температура.
Число уходящих молекул ν2 с единицы площади насыщенной поверхности равно числу молекул, обладающих энергией Едес (энергия активации десорбции), достаточной для отрыва от поверхности, т. е. ν2 пропорционально фактору Больцмана:

Учитывая уравнение (8) можно записать:
 (9)
(9)
Выражение (9) вместе с ранее полученными позволяет проанализировать зависимости константы скорости адсорбции от различных факторов.
Из уравнения (7) следует, что в начале процесса адсорбции, когда степень заполнения поверхности мала, скорость адсорбции максимальна, но мере же роста степени заполнения она снижается.
Если энергия активации десорбции велика, что характерно, например, для хемосорбции и конденсации пара на поверхности адсорбента, то вторым членом в уравнении (9) можно пренебречь и константа скорости будет пропорциональна давлению газа.
При малых давлениях скорость адсорбции мала и равновесие устанавливается очень долго, при больших же давлениях она может быть почти мгновенной. В зависимости от давления время установления адсорбционного равновесия может меняться от нескольких часов до 10-7 с.
Коэффициент α, выражающий долю от достигших поверхности молекул, способных к закреплению на ней, представляет собой вероятность того, что молекула закрепится на поверхности. Поэтому эта доля равна:
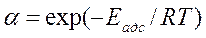 (10)
(10)
Энергия Еадс, необходимая для такого закрепления молекул, называется энергией активации адсорбции. Если энергия активации равна нулю, что в большинстве случаев характерно для физической адсорбции, то α= 1. Этот случай отвечает неактивированной адсорбции. Скорость неактивированной адсорбции обычно большая и, как видно из уравнения (9), уменьшается при р = const с повышением температуры.
Наличие потенциального барьера и необходимость предварительной затраты энергии (энергии активации) резко меняет характер кинетики адсорбции. Этим отличается активированная адсорбция. Скорость активированной адсорбции мала и увеличивается с повышением температуры (10). Потенциальный барьер возникает в том случае, если для совершения акта адсорбции необходимы предварительные перестройки, ориентирование атомов и молекул. Это в большей степени характерно для специфической химической адсорбции, энергия активации которой может достигать 40—150 кДж/моль.
Если после установления адсорбционного равновесия давление в системе уменьшить до нуля, то начнется процесс десорбции. Интегрируя уравнение (7) при условии пренебрежения адсорбцией, получим:
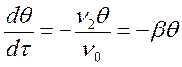
или

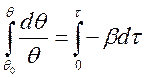
получаем
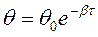
Коэффициент β пропорционален фактору Больцмана, который указывает на увеличение скорости десорбции с повышением температуры.
Дата добавления: 2021-11-16; просмотров: 725;











