Мономолекулярные односторонние последовательные реакции
Реакции считаются последовательными, если вещество, образующееся в одной реакции, является исходным для другой. Реакции часто встречаются на практике и могут быть моно-, би- или тримолекулярными, односторонними или обратимыми.
Рассмотрим последовательную одностороннюю реакцию первого порядка.
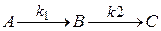
| |||
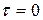
| 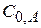
| ||
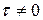
| 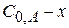
| 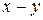
| 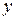
|
В – промежуточное вещество.
К любому времени 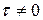
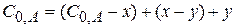
Составим кинетические уравнения для каждой стадии такой реакции
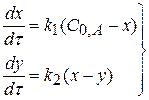 система дифференциалов кинетических уравнений
система дифференциалов кинетических уравнений
Для I стадии реакции:
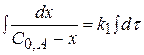 (реакция I порядка)
(реакция I порядка)
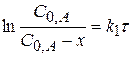 или
или 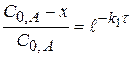 (4.14)
(4.14)
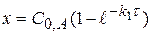 (4.15)
(4.15)
Для второй стадии реакции:
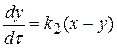 , проведя интегрирование получаем
, проведя интегрирование получаем
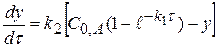 (4.16)
(4.16)
y = 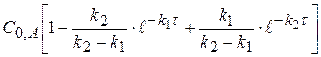 (4.17)
(4.17)
(x-y) = 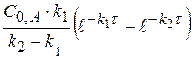 − концентрация промежуточного вещества B ко времени τ.
− концентрация промежуточного вещества B ко времени τ.
Анализ развития последовательной реакции:
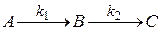

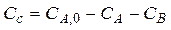
Одной из особенностей последовательных реакций является наличие на графике 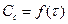 индукционного периода, когда конечный продукт почти не обнаруживается. Кривая в начальный период почти сливается с горизонтальной осью.
индукционного периода, когда конечный продукт почти не обнаруживается. Кривая в начальный период почти сливается с горизонтальной осью.
1) на кривой зависимости 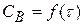 имеется max, соответствующий τmax. Как видно из рисунка, в момент max образования промежуточного вещества (B) наблюдается перегиб на кривой зависимости
имеется max, соответствующий τmax. Как видно из рисунка, в момент max образования промежуточного вещества (B) наблюдается перегиб на кривой зависимости 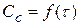 или y = f(τ)
или y = f(τ)
Рассчитаем значение τmax. Когда (x-y) = max, производная равна 0.
(x-y) = 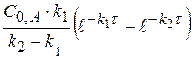
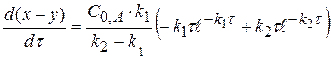
0 = 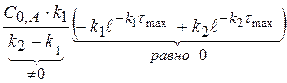
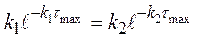
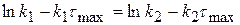
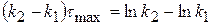
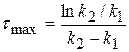 (4.18)
(4.18)
2) Найдем, чему будет равно 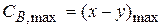 , для этого в уравнение подставим значение τmax:
, для этого в уравнение подставим значение τmax:
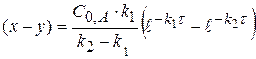 поделим на k1
поделим на k1
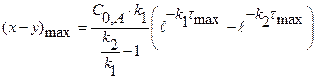
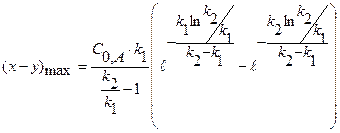 (4.19)
(4.19)
Как видно из уравнения (1.61) max количество промежуточного вещества (B) не зависит от абсолютного значения констант k2 и k1, а определяется только их соотношением. С увеличением соотношения γ = 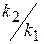
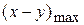 снижается.
снижается.
3) Рассмотрим 2 случая, когда γ1 = 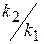 = 2 и γ2 =
= 2 и γ2 = 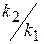 = 10.
= 10.

При γ2 = 10, во втором случае, промежуточное вещество будет превращаться значительно быстрее чем возникать (k2 >> k1), его можно не заметить 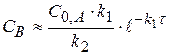 (4.20)
(4.20)
Если k1 >> k2, то скорость возникновения промежуточного продукта выше, чем его расходование. 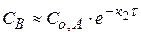 (4.21)
(4.21)
Основные понятия кинетики гетерогенных реакций
Гетерогенными называются процессы, происходящие на границе раздела соприкасающихся фаз. К ним относятся такие процессы как горение топлива, окисление металлов кислородом воздуха, реакции на поверхности катализаторов, кристаллизация чистых жидкостей и т.д.
Скорость гетерогенных процессов зависит от размеров и состояния поверхности раздела фаз, а так же от скорости их относительного движения.
Гетерогенные процессы многостадийны.
Гетерогенные процессы могут протекать на границе между разными фазами:
твердая-твердая, твердая - жидкая, твердая - газообразная, жидкая - жидкая, жидкая - газообразная.
Пусть твердое вещество A(T) реагирует на поверхности с веществом B(P) в растворе с образованием продукта реакции AB(P) в растворе:
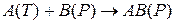
К таким реакциям относится реакция:
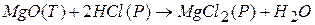
Эта реакция протекает на границе фаз 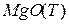 - раствор.
- раствор.
Можно выделить 3 основные стадии процесса:
1) доставка вещества из раствора к поверхности твердого тела;
2) собственно химическая реакция на поверхности твердого тела;
3) отвод продуктов реакции от поверхности вглубь раствора.
Каждая из этих стадий может быть лимитирующей, иметь наименьшую константу скорости и оказывать наибольшее сопротивление процессу.
Если определяющей стадией является химическая (стадия) реакция на границе раздела фаз, то гетерогенный процесс описывается законами химической кинетики и протекает в кинетической области.
Если, как это чаще бывает, медленнее осуществляется подвод и отвод соответствующих веществ, то гетерогенный процесс протекает в диффузионной области и описывается законами диффузии.
Температура сильнее влияет на скорость химической реакции, чем на диффузию. При повышении температуры гетерогенная химическая реакция может перейти из кинетической области в диффузионную.
Доставка вещества к границе между фазами осуществляется за счет конвекции и диффузии.
Конвекцией называется перемещение всей среды в целом. Она происходит из-за разности плотности раствора в объеме раствора и вблизи поверхности слоя. Конвекцию создают путем перемешивания твердого тела в растворе или раствора вблизи поверхностного слоя.
Диффузией называется перемещение молекул вещества в неподвижной среде под влиянием градиента концентраций. Количественные закономерности диффузии описываются двумя законами Фика.
Согласно первому закону Фика скорость диффузии 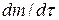 пропорциональна площади поперечного сечения S и градиенту концентрации
пропорциональна площади поперечного сечения S и градиенту концентрации 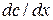 :
:
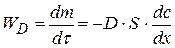 (4.22)
(4.22)
где D – коэффициент диффузии
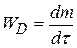 при S = 1м2 и
при S = 1м2 и 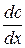 =
= 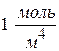
Коэффициент диффузии D возрастает с увеличением температуры, т.к коэффициент вязкости растворителя уменьшается. По уравнению Эйнштейна
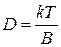 , где B – коэффициент трения (4.23)
, где B – коэффициент трения (4.23)
По закону Стокса для сферических частиц
B=6πηr, (4.24)
где η – коэффициент вязкости;
r – радиус частиц.
Тогда уравнение Эйнштейна можно записать:
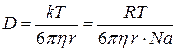 (4.25)
(4.25)
По второму закону Фика (устанавливается зависимость изменения концентрации в объеме от времени):
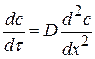 (4.26)
(4.26)
При стационарной диффузии, когда концентрация не зависит от времени, а изменяется только с расстоянием линейно:
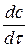 = 0 и
= 0 и 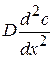 = 0 →
= 0 → 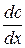 = const =
= const = 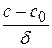 ,
,
где c и c0 – значения концентраций на расстоянии x = δ и x = 0
Исходя из этого, скорость стационарной диффузии будет равна:
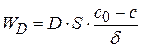 (4.27)
(4.27)
или
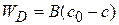 (4.28)
(4.28)
где 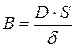 – коэффициент массопереноса; c0 – концентрация в поверхностном слое.
– коэффициент массопереноса; c0 – концентрация в поверхностном слое.
Для гетерогенной реакции, которая имеет I порядок и протекает стационарно, предположим, что скорость химической реакции равна скорости диффузии. Тогда можно записать:
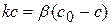 (4.29)
(4.29)
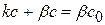
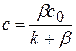 (4.30)
(4.30)
Подставим значение концентрации с в управление скорости реакции I порядка.
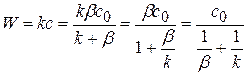 (4.31)
(4.31)
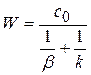 (4.32)
(4.32)
Дроби, стоящие в знаменателе – это диффузионное 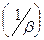 и химическое
и химическое 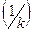 сопротивление.
сопротивление.
Когда 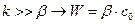 и определяется β , характеризующей диффузию. Процесс протекает в диффузионной области.
и определяется β , характеризующей диффузию. Процесс протекает в диффузионной области.
 Если
Если 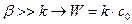 − суммарный процесс определяется химической стадией и протекает в кинетической области.
− суммарный процесс определяется химической стадией и протекает в кинетической области.
Влияние температуры на константу скорости гетерогенной реакции:
γ – температурный коэффициент скорости химической реакции
Дата добавления: 2018-05-10; просмотров: 1280;











