Тема 4.3 Аминокислоты и белки. Гетероциклические соединения
Аминокислоты – органические соединения, содержащие два типа функциональных групп с противоположными свойствами: аминогруппу (–NH2) и карбоксильную группу (–СООН). Они играют исключительно важную роль в жизни животных и растительных организмов.
Замечательным свойством живого является способность соединять аминокислоты друг с другом в различных комбинациях и последовательностях с образованием различных полиамидов: пептидов и белков, проявляющих совершенно разные свойства. Условно считают, что пептиды содержат до 100, а белки – свыше 100 аминокислотных остатков.
Молекулярная масса пептидов до 10 тыс., а у белков – от 10 тыс. до нескольких миллионов.
Аминокислоты рассматриваются как производные карбоновых кислот, в которых положение аминогруппы относительно карбоксильной принято указывать буквами α, β, γ и т. д., что равносильно цифрам 2, 3, 4 и т. д. соответственно.
Хотя в природных объектах и обнаружено около 300 разных аминокислот, но в состав большинства пептидов и белков входят 20 наиболее часто встречающихся и поэтому важных аминокислот, при чем все они α-аминокислоты. В α-аминокислотах карбоксильная и аминогруппы связаны с одним и тем же углеродным атомом (Сα), у которого кроме того, имеется заместитель R.
Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой температурой плавления, при нагревании разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Молекулы α-аминокислот содержат две различные кислотноосновные группы, т. е. являются амфолитами. Вследствие этого в их молекулах происходит перенос протона с карбоксильной группы на аминогруппу, т. е. прототропная таутомерия.
H2N–CRH–COOН ↔ H3N+ – CRH–COO–
Биполярно-ионная структура молекул α-аминокислот проявляется в их физических свойствах: аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, нелетучие , большинство их растворимы в воде и практически совсем нерастворимы в неполярных органических растворителях.
Кристаллическая решетка аминокислот – ионная, так как она стабилизирована электростатическими силами притяжения между противоположно заряженными ионизованными группами соседних молекул.
Простейший представитель – аминоуксусная кислота H2N–CH2–COOH – глицин.
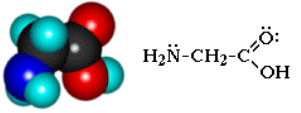
Аминокислоты классифицируют по двум структурным признакам. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
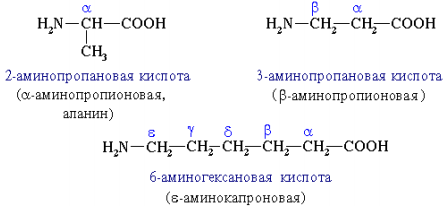
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита. Пример:
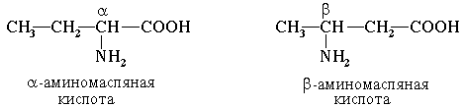
Для α-аминокислот R-CH(NH2)COOH, которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия. Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино-, три группы NH2 – триамино- и т. д.
Получение аминокислот:
1. Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
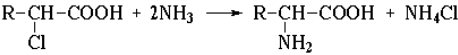
2. Присоединение аммиака к α-, β-непредельным кислотам с образованием β-аминокислот:
CH2=CH–COOH + NH3 → H2N–CH2–CH2–COOH.
3. Восстановление нитрозамещенных карбоновых кислот (применяется обычно для получения ароматических аминокислот):
O2N–C6H4–COOH + 3H2 → H2N–C6H4–COOH + 2H2O.
Химические свойства. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl → [H3N+–CH2–COOH]Cl–.
Как карбоновые кислоты они образуют:
а) соли
H2N–CH2–COOH + NaOH → H2N–CH2–COO–Na + H2O;
б) сложные эфиры
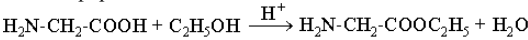
Кроме того, возможно взаимодействие амино- и карбоксильной групп как внутри одной молекулы (внутримолекулярная реакция), так и принадлежащих разным молекулам (межмолекулярная реакция).
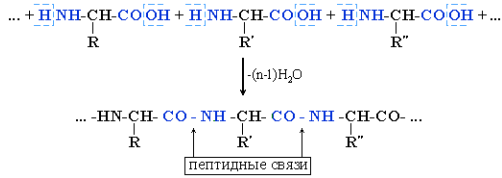
Межмолекулярное взаимодействие α-аминокислот приводит к образованию пептидов. При взаимодействии двух α-аминокислот образуется дипептид.
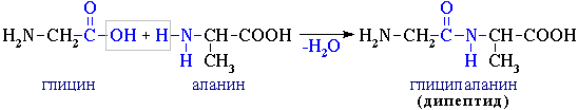
Во всех (кроме глицина) природных α-аминокислотах α – углеродный атом асимметрический, причем у большинства этих соединений (кроме изолейцина и треонина) имеется только один хиральный центр. Поэтому они существуют в виде двух оптических изомеров (L- и D-энантиомеров). Почти все природные α-аминокислоты имеют L-форму, а D-аминокислоты, как правило, не усваиваются живыми организмами. Интересно, что большинство аминокислот L-ряда имеют сладкий вкус, α-аминокислоты D-ряда – горькие или безвкусные.
Основным источником α-аминокислот для живых систем служат пищевые белки. Многие α-аминокислоты синтезируются в организме животных, но некоторые не синтезируются и должны поступать с пищей.
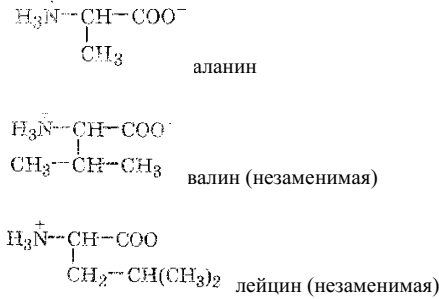
Это незаменимые аминокислоты: валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Остальные аминокислоты могут синтезироваться в организме животных, их называют заменимыми: аланин, аргинин, аспарагин, аспарагиновая кислота, глицин, глутамин, глутаминовая кислота, пролин, серин, цистеин, тирозин.
Интересный факт подметил Ю. А. Жданов (1968 г.): у большинства незаменимых кислот сумма степеней окисления углеродных атомов положительная, а у большинства заменимых – отрицательная. Это, по видимому, указывает на то, что заменимые аминокислоты по сравнению с незаменимыми эволюционно более молоды, т. е. что они возникли уже в окислительной атмосфере и поэтому содержат больше атомов электроотрицательных элементов (О, N, S).
α-аминокислоты с неполярным (гидрофобным) заместителем:
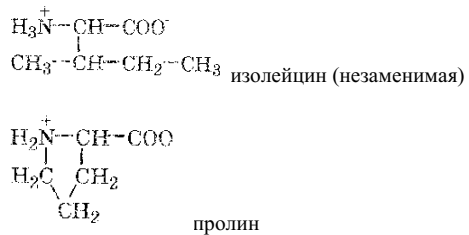
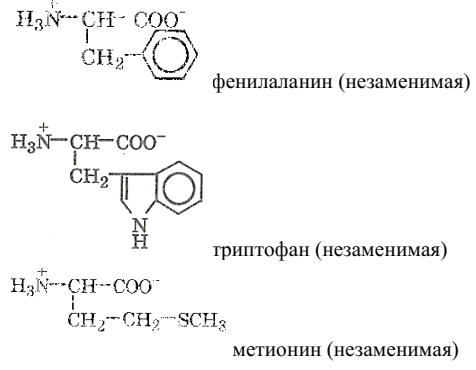
α-аминокислоты с полярным (гидрофильным) заместителем:
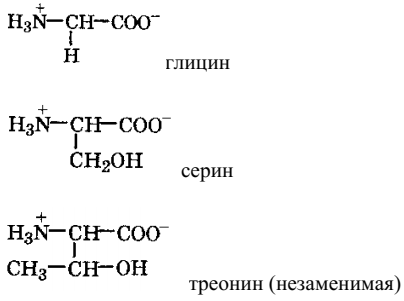
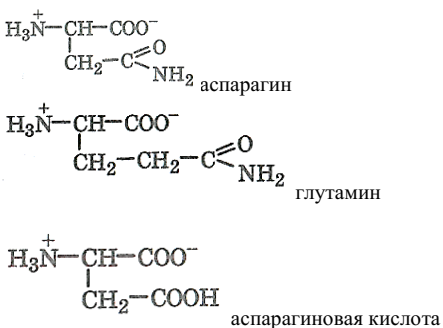
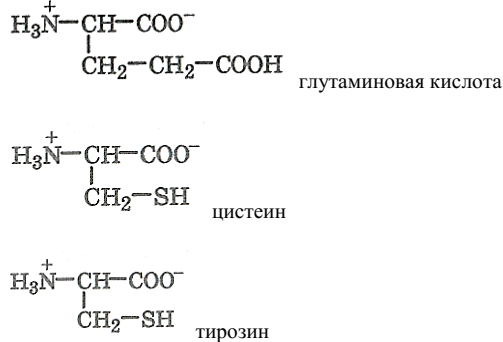
α-аминокислоты – основные:
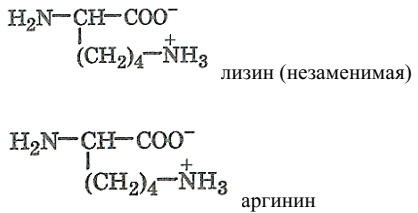
Белки (полипептиды) – биополимеры, построенные из остатков α-аминокислот, соединенных пептидными (амидными) связями. Формально образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот:
Функции белков в природе универсальны:
- каталитические (ферменты);
- регуляторные (гормоны);
- структурные (кератин шерсти, фиброин шелка, коллаген);
- двигательные (актин, миозин);
- транспортные (гемоглобин);
- запасные (казеин, яичный альбумин);
- защитные (иммуноглобулины) и т. д.
Свойства пептидов и белков зависят не только от числа и типа входящих в их состав аминокислот, но также от последовательности, в которой аминокислоты соединены между собой.
Особый характер белка связан не только с длиной и сложностью входящих в его состав пептидных цепей, но также и с тем способом, которым живые организмы синтезируют его в специфических конформациях и с различной степенью гидратации.
Разнообразные функции белков определяются α-аминокислотным составом, а также строением их высокоорганизованных макромолекул.
Выделяют четыре уровня структурной организации белков.
Первичная структура – определенная последовательность α-аминокислотных остатков в полипептидной цепи.
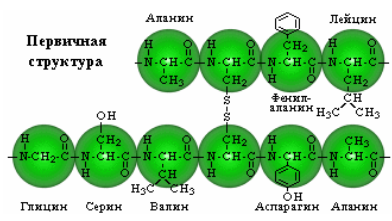
Вторичная структура – конформация полипептидной цепи, закрепленная множеством водородных связей между группами N–H и С=О.
Одна из моделей вторичной структуры – α-спираль.
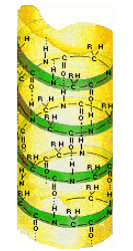
Третичная структура – форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков –S–S–, водородных связей, гидрофобных и ионных взаимодействий.
Четвертичная структура – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей.

Белки, дающие при гидролизе исключительно аминокислоты, называются простыми (протеинами). В зависимости от их свойств и биологических функций белки подразделяются на множество подгрупп.
1. Альбумины растворимы в воде, свертываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей.
Примерами их могут служить альбумин белка куриного яйца, альбумин кровяной сыворотки, молочный альбумин.
2. Глобулины нерастворимы в воде, но растворяются в очень слабых растворах солей. Более концентрированными растворами солей они вновь осаждаются. Осаждение происходит при меньшей концентрации, чем та, которая необходима для осаждения альбуминов. Эти белки являются очень слабыми кислотами. Примерами глобулинов могут служить фибриноген, глобулин кровяной сыворотки, глобулин мышечной ткани, глобулин белка куриного яйца. Таким образом, в белке куриного яйца, в крови, в мышечной ткани находятся и глобулины, и альбумины. Из глобулинов состоят и многие растительные белки.
3. Гистоны – белки основного характера. Они содержатся в нуклеопротеидах лейкоцитов и красных кровяных шариках.
4. Протамины не содержат серы, обладают сравнительно сильными основными свойствами, дают кристаллические соки. Они содержатся (в составе нуклеопротеидов) в сперматозоидах рыб и считаются простейшими из белковых веществ.
5. Проламины содержатся в зернах различных хлебных злаков. Замечательной их особенностью является растворимость в 80%-ном спирте. Представителем этих белков может служить глиадин, состав ляющий главную часть клейковины.
6. Склеропротеины – это нерастворимые белки, из которых состоят наружные покровы тел животных, они содержатся также в скелете и в соединительной ткани. К ним относятся кератин, коллагены, эластин, фиброин.
Кератин является главной составной частью волос, рогов, копыт, ногтей, перьев, верхнего слоя кожи. Скорлупа куриного яйца состоит из извести и кератина. Если растворить известь скорлупы яйца в кислоте, то остается мягкая пленка, состоящая из кератина. Кератин богат серой.
Коллагены содержатся в хрящах, т. е. из них состоит соединительная ткань. Кости позвоночных животных состоят из неорганических веществ (фосфата и карбоната кальция), жира и коллагенов.
Эластин входит в состав сухожилий и других эластичных соединительных тканей.
Нити сырого шелка состоят из белкового вещества – фиброина, покрытого серицином – белковым веществом, играющим роль шелкового клея. При кипячении с водой шелк освобождается от серицина, который при этом переходит в раствор.
Сложные белки, или протеиды, являются соединениями белков с небелковой частью. В зависимости от природы небелковой части различают несколько подгрупп протеидов.
1. Фосфоропротеиды. В их состав входит фосфорная кислота. Они в противоположность протаминам, обладающим основными свойствами, имеют кислотный характер.
Главным представителем фосфоропротеидов является казеин молока. Он обладает настолько явно выраженным кислотным характером, что разлагает углекислые соки с выделением двуокиси углерода. Казеин растворяется в слабых растворах щелочей, образуя с ними соли. Так, в молоке казеин содержится в виде кальциевой соли.
2. Нуклеопротеиды содержатся в клеточных ядрах. При осторожном гидролизе они расщепляются на белки и нуклеиновые кислоты.
3. Хромопротеиды – сочетание белков с окрашенными вещества ми. Из хромопротеидов наиболее изучен гемоглобин – красящее вещество красных кровяных шариков. Значение гемоглобина в жизни человека и животных очень велико. Он играет роль переносчика кислорода от легких к тканям. Кроме того, гемоглобин вместе с плазмой крови осуществляет регуляцию рН крови и перенос углекислоты в организме.
4. Гликопротеиды встречаются в слизистых выделениях животных организмов и обусловливают свойство этих выделений вытягиваться в нити даже при сравнительно большом разбавлении. Эти белки образуются в подчелюстной железе, печени, железах желудка и кишечника.
Исследованные представители гликопротеидов являются сочетанием белков с олиго- и полисахаридами.
5. Липопротеиды – соединения белков с веществами, родственны ми жирам (фосфатидами, сфингомиелинами, а также полиеновыми пигментами типа каротина). К белкам этого типа относится, например, зрительный пурпур сетчатки глаза. При гидролизе липопротеиды распадаются на белок и растворимые в эфире жиры, лецитин и другие фосфатиды.
Цветные реакции белков.
1.Биуретовая реакция белков. Раствор белка со щелочным раствором сульфата меди дает красно-фиолетовое или сине-фиолетовое окрашивание. Биуретовая реакция обусловлена наличием в молекулах белка пептидных групп –СО–NН–. Ионы Сu2+ меди образуют комплекс с енолизированными пептидными группами белка, Окраска растворов белка при образовании медного комплекса в случае биуретовой реакции может быть от синей до красной с преобладанием фиолетовой.
2.Нингидриновая реакция белков. Раствор белка с 1%-ным раствором нингидрина в 95%-ном растворе ацетона медленно окрашивается сине-фиолетовым (или желтовато-фиолетовым) оттенком, свидетельствующим о присутствии аминокислот, содержащих α-аминогруппы.
Нингидриновая реакция является одной из наиболее чувствительных для обнаружения α-аминогруппы. В результате взаимодействия α-аминогруппы аминокислоты или белка с нингидрином возникает Шиффово основание. Затем оно претерпевает перегруппировку, декарбоксилируется и расщепляется на альдегид и аминодикетогидридамин.
3.Ксантопротеиновая реакция. Смесь раствора белка и концентрированной азотной кислоты пробирке нагревают до кипения и кипятят около 2 мин. При нагревании раствор и осадок окрашиваются в яркожелтый цвет, при этом осадок может полностью раствориться в результате гидролиза. Смесь охлаждают и осторожно (по стенке пробирки) приливают избыток концентрированного раствора аммиака или щелочи до щелочной реакции. Выпадающий вначале осадок кислотного альбумината растворяется, и жидкость окрашивается в ярко оранжевый цвет. Ксантопротеиновая реакция происходит только при наличии в белках остатков ароматических аминокислот (фенилаланина, тирозина и триптофана). Желтоокрашенные нитросоединения образуются в результате нитрования ароматических радикалов этих аминокислот азотной кислотой. Изменение желтой окраски в оранжевую в щелочной среде обусловлено появлением хромофорной группы.
4.Реакцию Паули дают белки, содержащие в белковой молекуле остатки гистидина и тирозина. Раствор белка с 1%-ным раствором сульфаниловой кислоты в 5%-ном растворе соляной кислоты при добавлении 0,5%-ного раствора NaNO2 и 10%-ного раствора Na2СО3 дает вишнево-красное окрашивание.
5.Нитропруссидная реакция белков. Раствор белка с насыщенным раствором сульфата аммония и 5%-ным раствором нитропруссида натрия в щелочной среде образует красно-пурпурное окрашивание. Это доказывает, что в состав белка входит аминокислота цистеин.
6.Реакция на серу в белках. К раствору белка приливают 30%-ный раствор едкого натра и несколько капель уксуснокислого свинца. При наличии в молекулах белка аминокислот, содержащих серу (цистеин, цистин, метионин), отщепляется сера в виде ионов S2–, которые образуют с солями свинца черный осадок.
Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
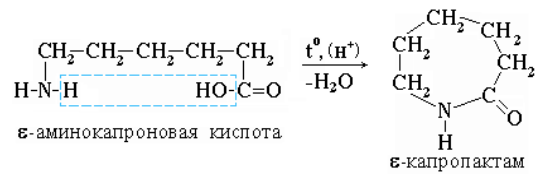
Гетероциклические соединения – это органические вещества, содержащие в своих молекулах циклы, в образовании которых кроме атомов углерода участвуют атомы других элементов (гетеро-атомы).
Наиболее распространены гетероциклы, в состав которых входят атомы азота, кислорода или серы.
Примером кислородсодержащих гетероциклических соединений служат циклические формы моносахаридов (глюкозы, рибозы и т. п.). Некоторые азотсодержащие гетероциклы играют важную роль в природе.
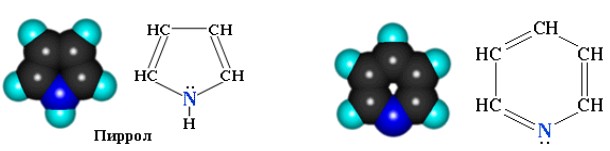
Атом азота в гетероциклах связан с углеродными атомами, поэтому такие соединения можно рассматривать как циклические амины.
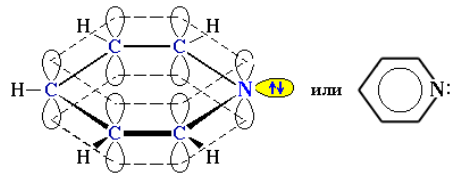
Пиридин С5H5N – шестичленный гетероцикл с одним атомом азота. Это бесцветная жидкость с неприятным запахом, температура кипения составляет 115 °С. Хорошо растворяется в воде и органических жидкостях. Ядовит.
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp2-гибридизации. Все σ-связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют π-электронную ароматическую систему.
Нуклеиновые кислоты – это биополимеры, макромолекулы которых состоят из многократно повторяющихся звеньев – нуклеотидов.
Поэтому их называют также полинуклеотидами.
В состав нуклеотида – структурного звена нуклеиновых кислот – входят три составные части: азотистое основание – пиримидиновое или пуриновое; моносахарид – рибоза или 2-дезоксирибоза; остаток фосфорной кислоты.
Нуклеотид – фосфорный эфир нуклеозида.
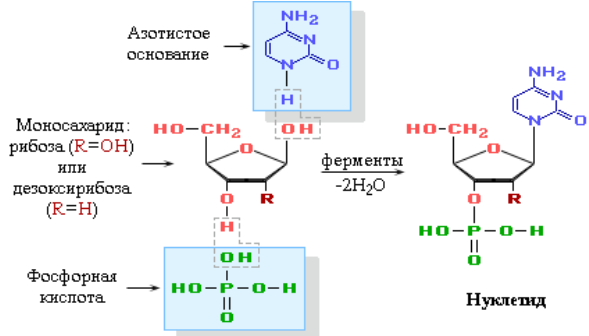
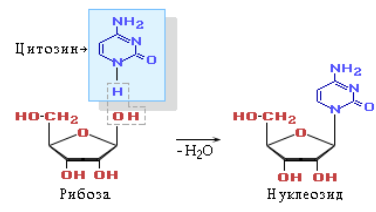
В состав нуклеозида входят два компонента: моносахарид (рибоза или дезоксирибоза) и азотистое основание.
Выдающийся немецкий химик Эмиль Фишер синтезировал 2,6,8-триоксипурин (мочевую кислоту) исходя из барбитуровой кислоты. Из мочевой кислоты Фишер получил аденин, гуанин и ксантин. Аденин и гуанин являются обычными компонентами нуклеиновых кислот.
Нуклеозидом называется N-гликозид, агликон которого представляет собой, как правило, производное пиримидина или пурина. В зависимости от того, какой сахар – рибоза или дезоксирибоза – входит в их состав, нуклеозиды подразделяются на рибозиды и дезоксирибозиды.
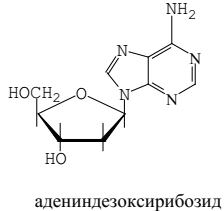
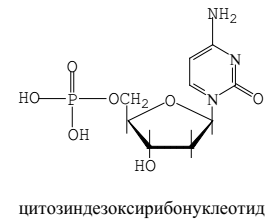
Нуклеотид - соединение, построенное из молекулы сахара, азотистого основания и фосфорной кислоты.
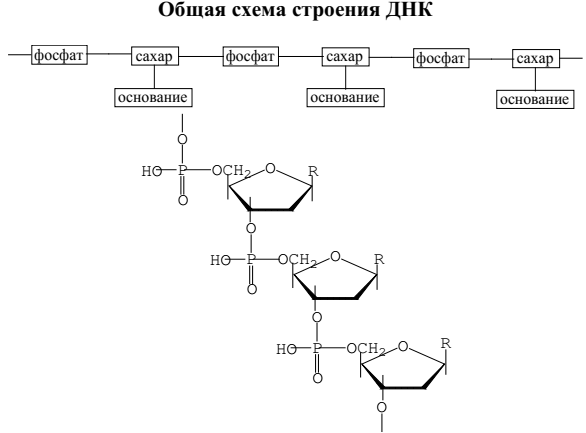
Число нуклеотидных единиц в ДНК может составлять от 3000 до 10000000. Последовательность азотистых оснований не установлена.
СПИСОК ЛИТЕРАТУРЫ
Основная:
1. Грандберг, И.И. Органическая химия: учебник для студентов высших учебных заведений по направлениям и специальностям агрономического образования / И. И. Грандберг, Н. Л. Нам. - 7-е изд., перераб. и доп. - Москва: Дрофа, 2009. - 607 с.
2. Органическая химия. Краткий курс: Учебное пособие/Иванов В. Г., Гева О. Н. - М.: КУРС, НИЦ ИНФРА-М, 2015. - 222 с.
3. Органическая химия: учебник / [Н.А. Тюкавкина, В.Л. Белобородов, С.Э. Зурабян и др.] ; под ред. Н. А. Тюкавкиной. - Москва : ГЭОТАР-Медиа, 2015. - 639 с.
4. Черных, В.П. Органическая химия / Под общ. ред. В.П. Черных. - 2-е изд., испр. и доп. - Харьков: Изд-во НфаУ; Оригинал, 2007. - 776 с.
5. Щербина, А. Э. Органическая химия. Основной курс : учебник / А. Э. Щербина, Л. Г. Матусевич ; ред. А. Э. Щербина . – Мн. : Новое знание ; М. : ИНФРА-М, 2014 . – 808 с.
Дополнительная:
1. Вайзман, Ф.Л. Основы органической химии / Франк Л. Вайзман; Перевод с англ. П. С. Лобанова; Под ред. А. А. Потехина. - СПб. : Химия : С.-Петерб. отд-ние, 1995. - 462 с.
2. Реутов, О. А. Органическая химия : [по направлению и специальности "Химия"]. - Москва : [б. и.]. Ч. 1. - 2-е изд. - 2005. - 566 с.
3.Степаненко, Б.Н. Курс органической химии. - М.: Высшая школа, 1981. - 432 с.
Периодические издания:
1. Журнал органической химии (2007-2017) - https://elibrary.ru/contents.asp?issueid=1391044. - Дата обращения 10.01.2018.
2. Вестник Воронежского государственного аграрного университета. Аграрные науки (2007-2017) - https://elibrary.ru/contents.asp?issueid=1234170. - Дата обращения 10.01.2018.
3. Журнал садоводство и виноградарство (2007-2017) - https://elibrary.ru/contents.asp?issueid=1013554. - Дата обращения 10.01.2018.
Internet-ресурсы:
1. Фролова В.В., Дьяконова О.В. Органическая химия: учебное пособие для бакалавров агрономических факультетов сельскохозяйственных вузов. Воронеж: ФГБОУ ВО ВГАУ, 2016. – 235с. [Электронный ресурс]. - Режим доступа: https://goo.gl/bNdz5u - Дата обращения 10.01.2018.
2. Органическая химия: веб-учебник. - Режим доступа: http://orgchem.ru/ - Дата обращения 10.01.2018.
3. Мануйлов А.В., Родионов В.И. Основы химии. Интернет-учебник. - Режим доступа: http://www.hemi.nsu.ru/- Дата обращения 10.01.2018.
4. Сельскохозяйственная электронная библиотека знаний (СЭБиЗ)-http://www.cnshb.ru/AKDiL. - Дата обращения 10.01.2018.
5. AGRICOLA – БД международная база данных на сайте Центральной научной сельскохозяйственной библиотеки РАСХН - http://www.cnshb.ru/f_t_jour.shtm. - Дата обращения 10.01.2018.
6. Сайт кафедры химии, страница «Учебный процесс» содержит необходимые учебные и методические сведения. http://chemistry.vsau.ru/?page_id=13. - Дата обращения 10.01.2018.
Дата добавления: 2018-05-10; просмотров: 1653;











