Тема 2.3 Непредельные углеводороды
Алкены – это углеводороды, которые имеют одну двойную связь при атоме углерода в sp2-гибридизации. Общая формула СnH2n. По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса -ан на -ен:
2 атома С → этан → этен; 3 атома С → пропан → пропен и т. д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной).
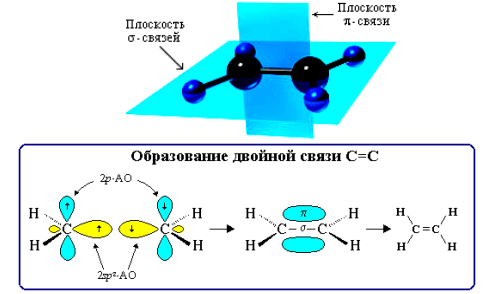
Рисунок 2.5 – Схема образования двойную связь при атоме углерода
в sp2-гибридизации
Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Цифра, обозначающая положение двойной связи, ставится обычно после суффикса -ен. Например:
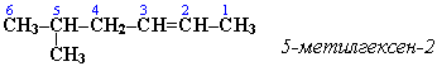
Для простейших алкенов применяются также исторически сложившиеся названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен (2-метилпропен) и т. п. В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкенов:
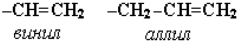
Изомерия углеродного скелета (начиная с С4Н8):
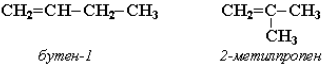
Изомерия положения двойной связи (начиная с С4Н8):

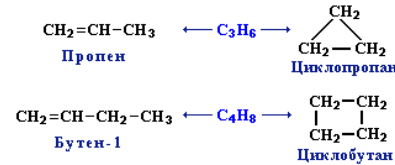
Межклассовая изомерия с циклоалканами, начиная с С3Н6:
Пространственная изомерия алкенов. Вращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения π-связи (π-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис-транс-изомерия. Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости
π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере.
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
Крекинг алканов:
С7Н16→СН3–СН=СН2 + С4Н10.
Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними π-связи.
Дегидрогалогенирование галогеналканов при действии спиртового
раствора щелочи:
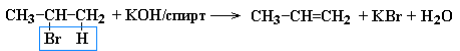
Дегидратация спиртов при повышенной температуре (выше 140 °C) в присутствии водоотнимающих реагентов:
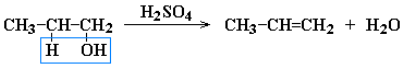
Реакции элиминирования идут в соответствии с правилом Зайцева: отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. Такие алкены обладают более низкой энергией.
Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов:
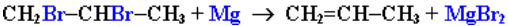
Дегидрирование алканов при 500 °С:
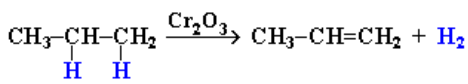
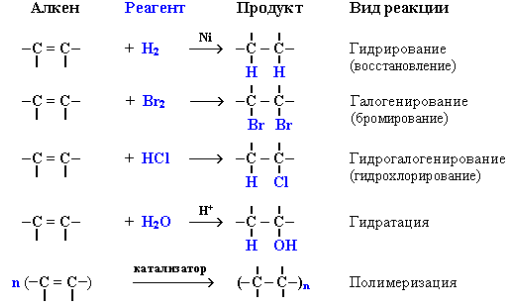
Реакции присоединения к алкенам идут по месту разрыва двойной связи. Алкены вступают в разнообразные реакции присоединения.
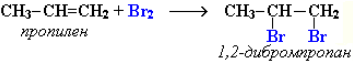
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:
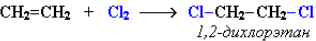
Еще легче происходит присоединение хлора:
Эти реакции протекают по механизму присоединения с гетеролитическим разрывом связей в молекуле галогена.
Гидрогалогенирование (присоединение галогеноводородов):
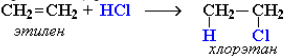
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH–СН3) определяется правилом Марковникова: в реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т. е. атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:

Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическое обоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.
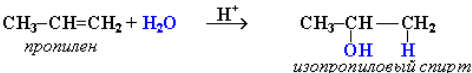
Гидратация (присоединение воды):

В реакциях несимметричных алкенов соблюдается правило Марковникова.
Полимеризация алкенов. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного. Реакции полимеризации алкенов идут за счет присоединения по кратным связям:

Реакции окисления алкенов. Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя. Мягкое окисление алкенов водным раствором перманганата калия
приводит к образованию двухатомных спиртов (реакция Вагнера):
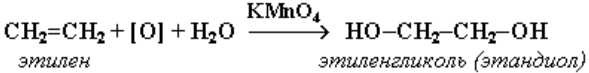
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
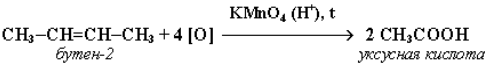
Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:
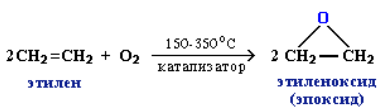
Полное окисление (горение):
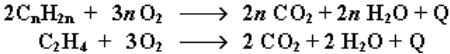
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
При нагревании до 500 °С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
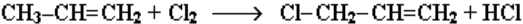
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ. Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений. Применяется как средство для ускоренного созревания фруктов. Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров. Изобутилен (2-метилпропен) Н2С=С(СН3)2 при меняется в производстве синтетического каучука.
Алкадиены, имеют общую формулу СnH2n–2. Главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода), в которых последняя буква заменяется окончанием -диен. Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия. Например :
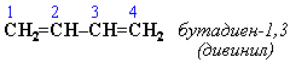
Название «дивинил» происходит от названия радикала –СН=СН2 «винил».
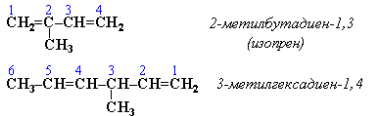
Изомерия сопряженных диенов. Структурная изомерия. Изомерия положения сопряженных двойных связей:
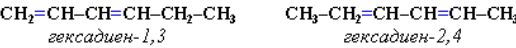
Изомерия углеродного скелета:
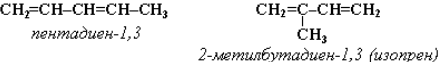
Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения:
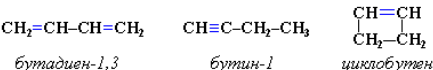
Пространственная изомерия. Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
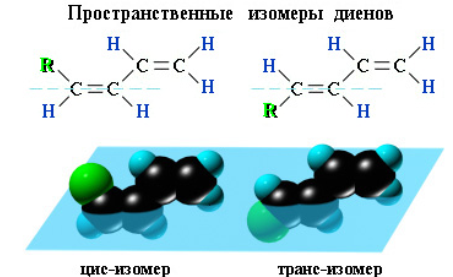
Рисунок 2.6 - Пространственная изомерия диенов
Алкины – это углеводороды, которые имеют одну тройную связь при атоме углеводорода в sp-гибридизации. Общая формула СnH2n–2.
По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса -ан на -ин:
2 атома С → этан → этин; 3 атома С → пропан → пропин и т. д.
Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т. е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса -ин. Например:
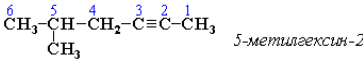
Для простейших алкенов применяются также исторически сложившиеся названия: ацетилен (этин), аллилен (пропин), кротонилен (бутин-1), валерилен (пентин-1). В номенклатуре различных классов органических соединений наиболее часто используются следующие одновалентные радикалы алкинов:

Тройная связь является комбинацией из одной σ- и двух π-связей, образуемых двумя sp-гибридизованными атомами. σ-связь возникает при осевом перекрывании sp-гибридных орбиталей соседних атомов углерода; одна из π-связей образуется при боковом перекрывании рy-орбиталей, другая – при боковом перекрывании рz-орбиталей.
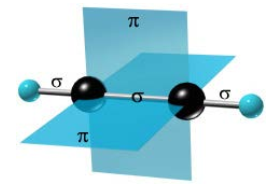
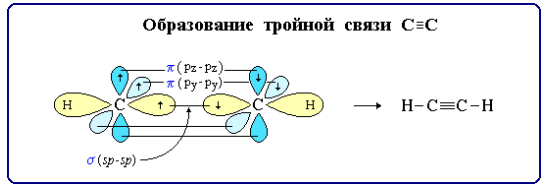
Рисунок 2.7 - Схема образования тройной связь при атоме углерода
в sp-гибридизации
σ-связи, образуемые sp-гибридными орбиталями углерода, располагаются на одной прямой (под углом 180° друг к другу). Поэтому молекула ацетилена имеет линейное строение.
Структурная изомерия.
Изомерия положения тройной связи (начиная с С4Н6):
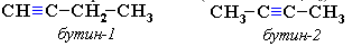
Изомерия углеродного скелета (начиная с С5Н8):
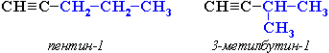
Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
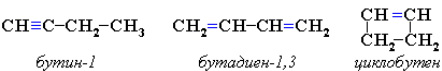
Пространственная изомерия относительно тройной связи в алкинах не проявляется, так как заместители могут располагаться только одним способом – вдоль линии связи.
Получение алкинов. Ацетилен является важнейшим исходным продуктом в производстве многих органических веществ и материалов. Его получают в больших количествах, используя ряд промышленных методов. Пиролиз метана:
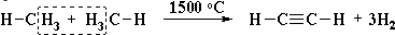
Реакцию проводят электродуговым способом, пропуская метан между электродами с временем контакта 0,1–0,01 секунды. Столь малое время нагревания обусловлено тем, что ацетилен при такой температуре может разлагаться на углерод и водород.
Пиролиз этана или этилена:

Гидролиз карбида кальция: СаС2 + 2Н2О → С2Н2 + Са(ОН)2.
Для синтеза гомологов ацетилена применяют следующие методы:
1) дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
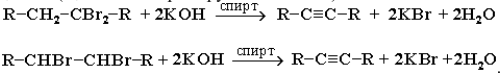
2) удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:

Химические свойства алкинов:
1. Реакции присоединения к алкинам.
Гидрирование. В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая π-связь), а затем алканов (разрывается вторая π-связь):
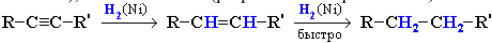
При использовании менее активного катализатора гидрирование останавливается на стадии образования алкенов.
Галогенирование. Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):
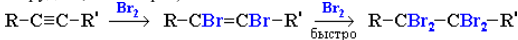
Алкины обесцвечивают бромную воду (качественная реакция). Реакции взаимодействия с галогенами идет при н.у. или с катализатором AlCl3
CН≡СН + Br2 → CHBr═CHBr → CHBr2 –CHBr2.
этин 1,2-дибромэтен 1,1,2,2-тетрабромэтан
Гидрогалогенирование. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова:
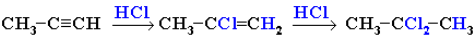
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида:
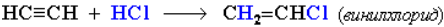
Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Гидратация (реакция Кучерова). Присоединение воды происходит в присутствии катализатора соли ртути(II) и идет через образование не устойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена):
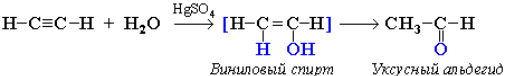
или в кетон (в случае других алкинов):
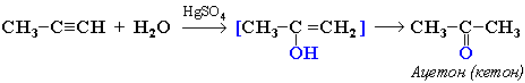
Полимеризация. Димеризация под действием водно-аммиачного раствора CuCl:
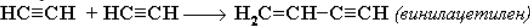
Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):
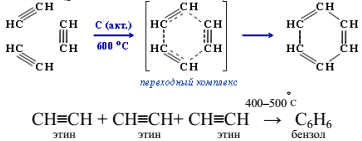
Возможно образование молекул, содержащих большее число звеньев ацетилена как циклического, так и линейного строения (–СН=СН–СН=СН–СН=СН–). Такие полимеры обладают полупроводниковыми свойствами). Высокомолекулярное вещество – карбин (одна из аллотропных модификаций углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl:
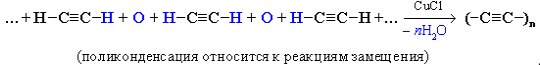
Образование солей. Ацетилен и его гомологи с концевой тройной связью R–C≡C–H (алкины-1) вследствие полярности связи С(sp)-Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды:
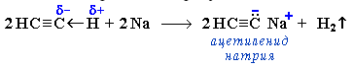
Ацетилениды щелочных и щелочноземельных металлов используются для получения гомологов ацетилена. При взаимодействии ацетилена (или R–C≡C–H) с аммиачными растворами оксида серебра или хлорида меди(I) выпадают осадки нерастворимых ацетиленидов:

Если тройная связь находится не на конце углеродной цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются:
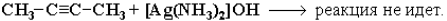
Окисление алкинов. Ацетилен и его гомологи легко окисляются различными окислителями (перманганатом калия в кислой и щелочной среде, дихроматом калия в кислой среде и др.). Строение продуктов окисления зависит от природы окислителя и условий проведения реакций. При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:

Алкины обесцвечивают разбавленный раствор перманганата калия, что используется для доказательства их ненасыщенности. В этих условиях происходит мягкое окисление без разрыва σ-связи С–С (разрушаются только π-связи). Например, при взаимодействии ацетилена с разбавленным раствором KMnO4 при комнатной температуре возможны следующие превращения с образованием щавелевой кислоты HOOC–COOH:
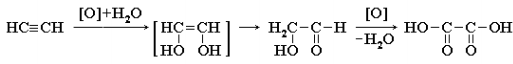
При сгорании алкинов происходит их полное окисление до CO2 и H2O. Горение ацетилена сопровождается выделением большого количества тепла (Q = 1300 кДж/моль):
2С2Н2 + 5О2 → 4СО2 + 2Н2О.
Температура ацетиленово-кислородного пламени достигает более 2800–3000 °С. На этом основано применение ацетилена для сварки и резки металла. Ацетилен образует с воздухом и кислородом взрывоопасные смеси. В сжатом, и особенно в сжиженном, состоянии ацетилен способен взрываться от удара. Поэтому он хранится в стальных баллонах в виде растворов в ацетоне, которым пропитывают асбест. Наибольшее практическое значение имеют ацетилен H–C≡C–H и винилацетилен CH2=CH–C≡CH. Ацетилен используется для получения самых разнообразных веществ.
Ароматическими соединениями (аренами) называются плоские сопряженные системы с числом π-электронов 4n+2. Арены имеют общую формулу СnH2n–6, (n≥6). Бензол С6Н6 – родоначальник ароматических углеводородов.
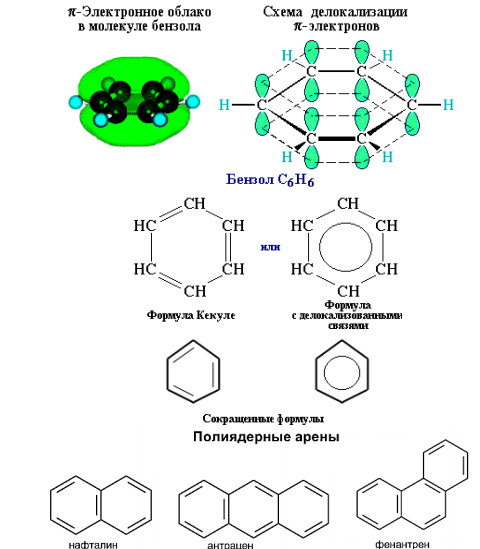
Рисунок 2.8 – Модель ароматических соединений (арены)
Атомы углерода в состоянии sp2-гибридизации и связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы между каждой парой π-связей равны 120°. Таким образом, скелет σ-связей представляет собой правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости. р-электроны всех атомов углерода взаимодействуют между собой путем бокового перекрывания соседних 2р-АО, расположенных перпендикулярно плоскости σ-скелета бензольного кольца. Они образуют единое циклическое π-электронное облако, сосредоточенное над и под плоскостью кольца.
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С6Н5–R алкилбензол. Широко используются тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
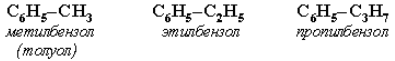
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Например:
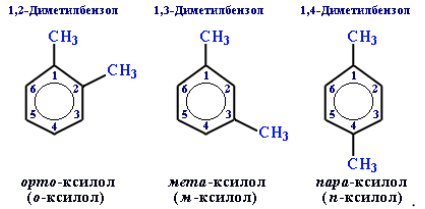
Для дизамещенных бензолов R–C6H4–R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
- орто- (о-) заместители у соседних атомов углерода кольца, т. е. 1,2-;
- мета- (м-) заместители через один атом углерода (1,3-);
- пара- (п-) заместители на противоположных сторонах кольца (1,4-).
Ароматические одновалентные радикалы имеют общее название «арил». Из них наиболее распространены в номенклатуре органических соединений два: C6H5- (фенил) и C6H5CH2- (бензил).
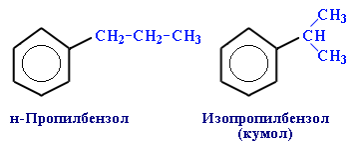
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
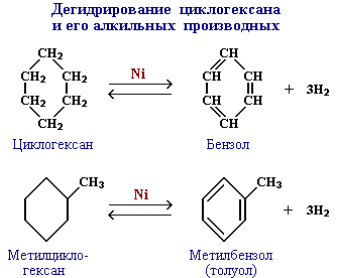
При дегидрировании этилбензола образуется производное бензола с непредельной боковой цепью – винилбензол (стирол) C6H5–CН=СН2 (исходное вещество для получения ценного полимера полистирола).
Реакции получения аренов указывают на взаимосвязь между различными группами углеводородов и на возможность их превращения друг в друга.
Химические свойства аренов. Реакции замещения в бензольном кольце. Электрофильное замещение.
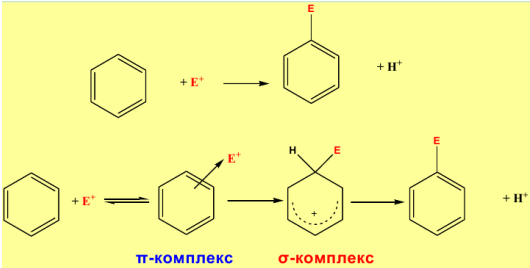
Галогенирование. Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 и т. п. (кислот Льюиса):
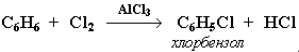
Нитрование. Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
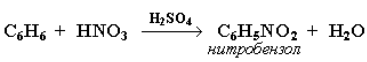
Алкилирование. Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
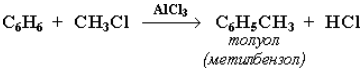
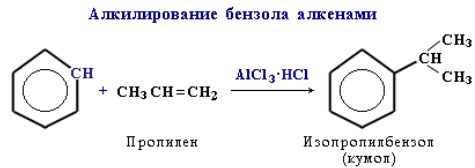
Замещение в алкилбензолах. Гомологи бензола (алкилбензолы) более активно вступают в реакции замещения по сравнению с бензолом. Например, при нитровании толуола С6Н5CH3 может происходить замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
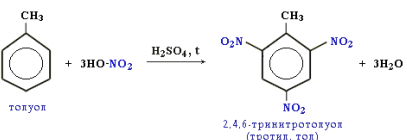
Под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4. Толуол в отличие от метана окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
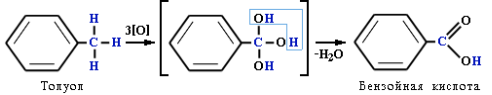
Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
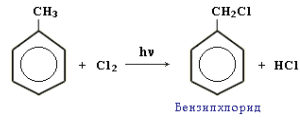
Реакции присоединения к аренам. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
Гидрирование. Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
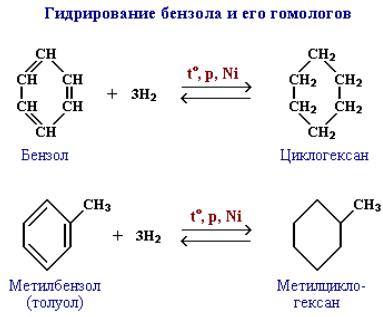
Эта реакция является обратной образованию бензола при дегидрировании циклогексана.
Радикальное хлорирование аренов. В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. При радикальном хлорировании бензола получен «гексахлоран» (средство борьбы с вредными насекомыми).
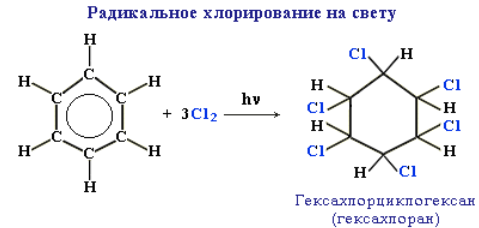
Применение гексахлорана в настоящее время запрещено из-за его токсичности для человека и животных. Заметим, что в случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи:
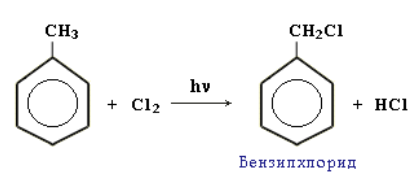
Реакции окисления аренов. Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т. п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
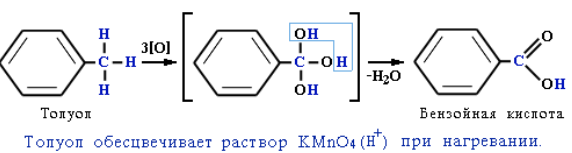
Окисление других гомологов (этилбензол, пропилбензол и т. д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
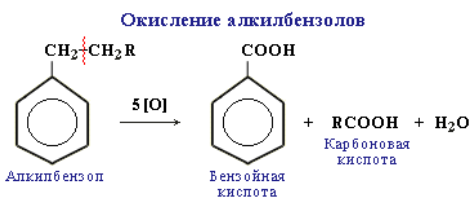
Алкильные группы в алкилбензолах окисляются легче, чем алканы. Это объясняется влиянием бензольного кольца на атомы в боковой цепи. Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах:
2С6Н6 + 15О2 → 12СО2 + 6Н2О.
Дата добавления: 2018-05-10; просмотров: 2854;











