Тема 3.3 Карбоновые кислоты
Карбоновые кислоты – органические соединения, содержащие одну или несколько карбоксильных групп –СООН. Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова «кислота» (см. приложение табл. 3).
Часто используются также тривиальные названия:
- HCOOH – метановая, муравьиная;
- CH3COOH – этановая, уксусная;
- C2H5COOH – пропановая, пропионовая;
- C3H7COOH – бутановая, масляная;
- C4H9COOH – пентановая, валерьяновая;
- C5H11COOH – гексановая, капроновая;
- C15H31COOH – пальмитиновая;
- C17H35COOH – стеариновая.
Карбоновые кислоты классифицируют по двум структурным признакам.
По числу карбоксильных групп кислоты подразделяются:
- на одноосновные (монокарбоновые). Например :

- многоосновные (дикарбоновые, трикарбоновые и т. д.).
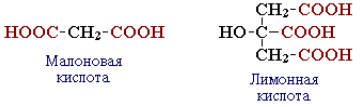
По характеру углеводородного радикала различают кислоты:
- предельные (например, CH3CH2CH2COOH);
- непредельные (CH2=CHCH2COOH);
- ароматические (RC6H4COOH).
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга. Карбоксильная группа содержит две функциональные группы – карбонил > С=О и гидроксил –OH, непосредственно связанные друг с другом.
Электронное строение группы –СООН придает карбоновым кислотам характерные химические и физические свойства. Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную (по сравнению со спиртами и фенолами) поляризацию связи О–Н, что определяет подвижность водородного атома (кислотные свойства).
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН. Группа –СООН за счет положительного заряда на атоме углерода снижает электронную плотность на связанном с ней углеводородном радикале.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
RCOOH ↔ RCOO– + H+.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Методы получения кислот окислением альдегидов, спиртов, нитрилов:
1. Окисление альдегидов и первичных спиртов – общий способ получения карбоновых кислот. В качестве окислителей применяются KMnO4 и K2Сr2О7.
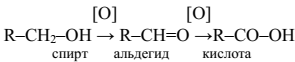
2. Другой общий способ – гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. При этом образуются спирты, содержащие группы ОН у одного атома углерода – такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
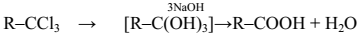
3. Получение карбоновых кислот из цианидов (нитрилов) – это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
СН3–Вr + NaCN → CH3 – CN + NaBr.
Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:
CH3CN + 2Н2О → CH3COONH4.
При подкислении раствора выделяется кислота:
CH3COONH4 + HCl → СН3СООН + NH4Cl.
4. Использование реактива Гриньяра по схеме:
R–MgBr + СО2 → R–COO–MgBr + Н2О → R–COOH + Mg(OH)Br.
5. Гидролиз сложных эфиров:
R–COOR1 + КОН → R–COOK + R'OH;
R–COOK + HCl → R–COOH + KCl.
6. Гидролиз ангидридов кислот:
(RCO)2O + Н2О → 2RCOOH.
7. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода(II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
200 °С, Р
NaOH + СО → HCOONa + H2SO4→НСООН.
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.
Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия:
5С6Н5–СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 3K2SO4 +
+ 6MnSO4 + 14H2O.
Кроме того, бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают 40–60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и соответственно фенилметанола (бензилового спирта):
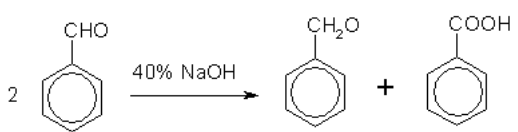
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т. е. соединения, полученные в результате реакций по карбоксильной группе.
1. Образование солей:
а) при взаимодействии с металлами:
2RCOOH + Mg → (RCOO)2Mg + H2;
б) в реакциях с гидроксидами металлов:
RCOOH + NaOH→RCOONa+H2O.
в) при взаимодействии с содой:
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl →СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООK + Н2О → СН3СООН + KОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
2. Образование амидов:
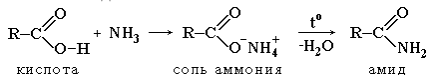
3. Образование сложных эфиров R'–COOR":
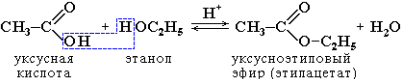
4. Взаимодействие с солями:
2CH3COOH+CaCO3 → (CH3COO)2Ca+H2O+CO2.
5. Действие галогенирующих агентов
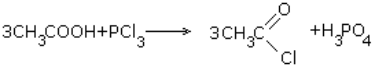
6. Галогенирование кислот:
CH3COOH+Br2 → CH2BrCOOH + HBr.
7. Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН–СООН + Н2 → СН3–СН2–СООН;
СН2=СН–СООН + Сl2 → СН2Сl–СНСl–СООН;
СН2=СН–СООН + HCl → СН2Сl–СН2–СООН;
СН2=СН–СООН + Н2O → НО–СН2–СН2–СООН.
Две последние реакции протекают против правила Марковникова.
8. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже углеводороды:
2[Н]
СН3СООН → СН3СНО + Н2О;
4[Н]
СН3СООН → СН3СН2ОН + Н2О;
6[Н]
СН3СООН → С2Н6 + 2Н2О.
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот.
9. Исключение составляет муравьиная кислота:
Н2SО4(конц)
НСООН → СО + Н2О.
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
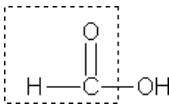
Муравьиная кислота – сильный восстановитель и легко окисляется до СО2. Она дает реакцию «серебряного зеркала»:
НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O,
или в упрощенном виде:
НСООН + Аg2О → 2Аg + СО2 + Н2О
Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2 → СО2 + 2HCl.
10. В атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О:
СН3СООН + 2О2 → 2СО2 + 2Н2О.
11. Реакции декарбоксилирования. Насыщенные незамещенные монокарбоновые кислоты из-за большой прочности связи С–С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление соли щелочного металла карбоновой кислоты со щелочью:
t°
CH3–CH2–COONa + NaOH → С2Н6↑ + Na2CO3.
12. Появление электронодонорных заместителей в углеводородном радикале способствует реакции декарбоксилирования:
70°C
ССl3СООН → CHCl3↑ + СО2↑.
Двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании:
НООС–СН2–СООН → СН3СООН + CO2↑.
Вследствие ассоциации молекул карбоновые кислоты имеют высокие температуры кипения и плавления. При нормальных условиях они существуют в жидком или твердом состоянии.
Например, простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с температурой кипения 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота). Простейшая ароматическая кислота – бензойная C6H5COOH (температура плавления 122,4 °С) – легко возгоняется, т. е. переходит в газообразное состояние, минуя жидкое. При охлаждении ее пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Растворимость карбоновых кислот в воде обусловлена образованием межмолекулярных водородных связей с растворителем:
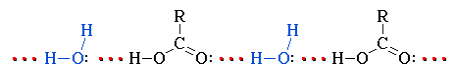
Низшие гомологи С1–С3 смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость кислот в воде уменьшается. Высшие кислоты, например, пальмитиновая C15H31COOH и стеариновая C17H35COOH – бесцветные твердые вещества, нерастворимые в воде.
Муравьиная кислота применяется в качестве восстановителя, в медицине – муравьиный спирт (1,25%-ный спиртовой раствор муравьиной кислоты).
Уксусная кислота применяется для синтеза красителей, медицинских препаратов, сложных эфиров, при производстве ацетатных волокон. В домашнем хозяйстве – как вкусовое и консервирующее вещество.
Дата добавления: 2018-05-10; просмотров: 2525;











