РАЗДЕЛ 4. ПРИРОДНЫЕ И БИОЛОГИЧЕСКИ АКТИВНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Тема 4.1 Липиды
Липиды – это большая и разнородная группа природных соединений, объединяемых общим свойством – практической их нерастворимостью в воде и хорошей растворимостью в органических растворителях. Липиды в зависимости от способности к гидролизу разделяют на омыляемые и неомыляемые.
Омыляемые липиды подразделяют на простые и сложные. Простые липиды при гидролизе образуют два компонента: спирты и карбоновые кислоты. К простым омыляемым липидам относят жиры и воски. К сложным липидам относят фосфолипиды, сфинголипиды и гликолипиды, которые при гидролизе образуют три и более компонента.
Неомыляемые липиды, выполняющие в организме роль низкомолекулярных биорегуляторов, включают стероиды, жирорастворимые витамины и простагландины.
Природные животные и растительные жиры представляют собой триацилглицерины, т. е. сложные эфиры глицерина и высших прямоцепочечных (жирных) карбоновых кислот общей формулы
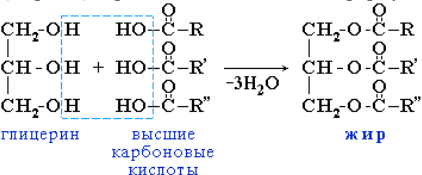
где R, R', R" – углеводородные радикалы.
Поскольку во всех природных жирах спирт один и тот же – глицерин, то наблюдаемые различия между жирами обусловлены исключительно строением их жирных кислот. В триацилглицеринах животного происхождения преобладают остатки насыщенных кислот, поэтому животные жиры, как правило, твердые. Растительные жиры содержат в основном остатки ненасыщенных кислот, из-за чего они, как правило, жидкие, и их называют маслами. Число углеродных атомов в природных жирных кислотах колеблется от 4 до 22, но чаще встречаются кислоты с 16 или 18 углеродными атомами. Среди насыщенных кислот это пальмитиновая (C15H31COOH) и стеариновая (С17Н35СООН) кислоты, а ненасыщенные кислоты в основном представлены олеиновой (С17Н33СООН), линолевой (C17H31COOH) и линоленовой (С17Н29СООН) кислотами.
В жире человека, плавящемся при 15 °С (в организме он жидкий), содержатся в основном кислоты (%): пальмитиновая 25, стеариновая 8, олеиновая 50 и линолевая 10. Однако жиры, выделенные из разных органов человека, имеют разный состав. Так, в подкожной жировой клетчатке больше остатков насыщенных кислот, а в жирах печени – ненасыщенных жирных кислот.
Триацилглицерины могут содержать или только один, или два разных, или три разных ацильных остатка:
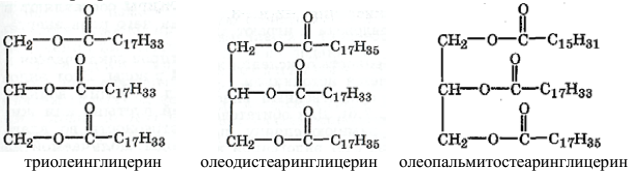
В большинстве жиров ацильные остатки распределены по «принципу равномерного распределения». Например, масло какао, содержащее ацильные остатки пальмитиновой, стеариновой и олеиновой кислот примерно в равном молярном соотношении, состоит в большей степени (55 %) из олеопальмитостеарина, тогда как трипальмитин, тристеарин и триолеин содержатся в нем в незначительных количествах. В животных и растительных маслах положение 2 (среднее) обычно занято ацильными остатками ненасыщенных кислот.
Физико-химические свойства жиров. Природные жиры представляют собой сложные смеси смешанных триацилглицеридов, находящихся в разных полиморфных кристаллических формах, поэтому они плавятся не при определенной температуре, а в температурном интервале. Для характеристики жиров наряду с температурой плавления часто используется температура застывания, которая всегда ниже и тоже имеет температурный интервал. Основные фрагменты молекул жиров содержат много неполярных (С–С) и малополярных (С–Н) связей, из-за чего у их молекул в целом значительно преобладают гидрофобные (липофильные) свойства. Поэтому жиры хорошо растворимы в органических растворителях, таких как бензин, эфир, хлороформ, а масла используются для растворения пахучих веществ в парфюмерии.
Неполярная природа жиров служит причиной их низкой электро- и теплопроводности. Поэтому жиры для многих живых организмов служат защитой как от охлаждения, так и от перегрева. Жиры практически нерастворимы в воде, однако в присутствии таких поверхностно активных веществ, как желчные кислоты, белки, мыла, шампуни, они могут образовывать устойчивые эмульсии в воде. На этом основано усвоение жиров в организме и моющее действие растворов ПАВ.
Устойчивой сложной (эмульсия и суспензия) природной дисперсной системой является молоко, в котором частички жидких и твердых жиров стабилизированы белками.
При окислении жиров в организме выделяется 39 кДж на 1 г жира, что более чем в 2 раза превосходит тепловой эффект окисления углеводов или белков. Это связано с тем, что в жирах большинство углеродных атомов имеют более отрицательную степень окисления: -2 и -3. Жиры составляют в норме до 20 % массы человека и играют для него роль энергетических ресурсов.
Другая важная особенность окисления жиров заключается в том, что 1 г жира является источником 1,4 г воды. Этот эндогенный источник дает существенный вклад в общий водный баланс организма. Для обитателей пустынь или животных, впадающих в зимнюю спячку, потребность во влаге часто удовлетворяется за счет эндогенной воды, получаемой из жира.
Химические свойства: омыление, гидрогенизация. Прогоркание жиров Среди реакций жиров особое значение имеет гидролиз. С его помощью получают ценные продукты: глицерин, жирные кислоты, их соли (мыла), а также устанавливают состав жиров. Гидролиз – первая химическая стадия метаболизма жиров в организме.
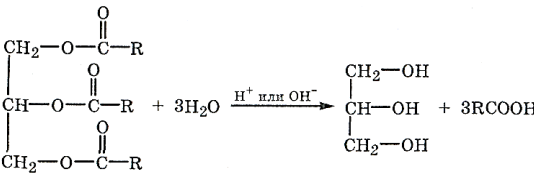
Щелочной гидролиз называется омылением, так как при нем образуются мыла – соли жирных кислот. В организме гидролиз жиров происходит под действием ферментов липаз. Гидролитический распад животных жиров и жиров зерна, крупы, муки и других жиросодержащих продуктов под действием ферментов или микроорганизмов является одной из причин ухудшения их качества при хранении и порчи. Этот процесс особенно ускоряется с повышением влажности продуктов и при условиях, способствующих их окислению.
Трансацилирование жиров (переэтерификация). Триацилглицериды в присутствии катализаторов (H2SO4, СН3ONа) и ферментов способны к обмену ацилами:
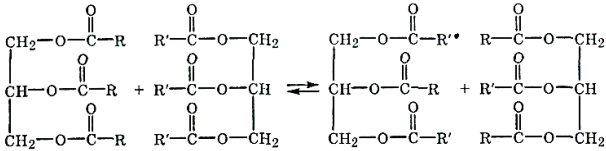
Межмолекулярное и внутримолекулярное трансацилирование при водит к изменению свойств масел и жиров. Поэтому данная реакция широко применяется в пищевой промышленности для получения пищевых жиров с заданными свойствами.
Реакция присоединения. Жиры, содержащие остатки непредельных кислот, легко присоединяют по двойным связям галогены, воду и аммиак. На присоединении иода по кратным связям основано определение йодного числа, являющегося мерой ненасыщенности жира или масла.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел.
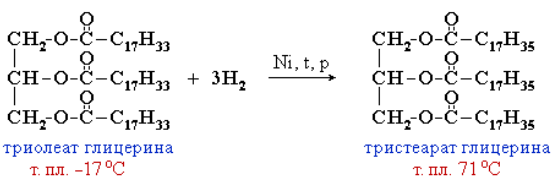
Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – пищевой жир, состоит из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкового и др.), животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
В условиях процесса гидрогенизации масел (высокая температура, металлический катализатор) происходит изомеризация части кислотных остатков, содержащих цис-связи С=С, в более устойчивые транс-изомеры. Повышенное содержание в маргарине (особенно, в дешевых сортах) остатков транс-ненасыщенных кислот увеличивает опасность атеросклероза, сердечно-сосудистых и других заболеваний.
В связи с тем, что твердых жиров не хватает для пищевых и технических целей, большое промышленное значение приобрела реакция каталитического гидрирования двойных связей в более дешевых жидких жирах. При этом жидкие ненасыщенные жиры переходят в твердые, так как становятся насыщенными. Процесс протекает в присутствии никелевого катализатора при температуре 160–200 °С и давлении водорода 2–15 атмосфер. Получаемые продукты гидрирования называются салолин или саломас, они используются для изготовления маргарина путем их эмульгирования в молоке с добавками веществ, придающих маргарину вкус и запах сливочного масла.
По реакции переэтерификации получают смеси сложных эфиров жирных кислот, которые в отличие от самих кислот легко летучи и могут быть разделены путем перегонки или газожидкостной хромато графии. Далее путем гидролиза их превращают в индивидуальные карбоновые кислоты или используют в виде эфиров, например, в качестве лекарственных препаратов, восполняющих недостаток незаменимых жирных кислот в организме (лекарственный препарат линетол).
Триацилглицериды, содержащие остатки ненасыщенных жирных кислот, вступают в реакции присоединения по двойной связи.
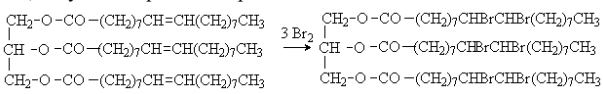
Реакция присоединения галогенов используется для определения содержания остатков ненасыщенных кислот в жирах. Количественной характеристикой степени ненасыщенности жиров служит иодное число – количество иода (в граммах), которое могут поглотить 100 г жира. У животных жиров иодное число меньше 70, у растительных масел больше 70.
Реакция окисления. Жиры и масла, особенно содержащие ацильные остатки ненасыщенных жирных кислот, окисляются кислородом воздуха по свободнорадикальному механизму. Первыми продуктами окисления являются разнообразные по строению пероксиды и гидропероксиды. Эти нестойкие продукты превращаются во вторичные продукты окисления: спирты, альдегиды, кетоны и кислоты с углеродной цепочкой различной длины. Повышение температуры, влажности и воздействие света ускоряют процесс пероксидного окисления липидов.
Накопление продуктов окисления в жирах и маслах приводит к снижению их пищевой ценности, а некоторые продукты окисления оказывают вредное воздействие на организм. Этот процесс называют окислительным прогорканием. Для предотвращения или замедления процесса окисления жиров к ним добавляют антиоксиданты на основе алкилзамещенных фенолов или гидрохинонов, которые, являясь восстановителями, служат ловушками для радикальных частиц активных форм кислорода.
Полимеризация масел. Весьма важными с позиции образования защитных пленок являются реакции автоокисления, сопровождаемые полимеризацией масел. По этому признаку растительные масла делятся на три категории: высыхающие (иодное число более 150), полувысыхающие (90–150) и невысыхающие (ниже 90).
Основной характерной чертой высыхающих масел (льняное, тунговое) является высокое содержание в них ацильных остатков непредельных кислот с двумя или тремя двойными связями. Эти масла, содержащие СН2-группу между двумя двойными связями, очень легко образуют радикалы и, подвергаясь автоокислению, полимеризуются с образованием эластичных блестящих прочных пленок, нерастворимых в органических растворителях и устойчивых к внешним воздействиям. На этом основано использование таких масел для приготовления лаков, красок и олифы.
Полувысыхающими маслами являются подсолнечное и хлопковое, в которых содержание линолевой кислоты достигает 50 %, а невысыхающими – масла типа оливкового (линолевой кислоты не более 15–20 %).
Воски. Природные воски – это сложные смеси эфиров одноатомных первичных высших прямоцепочечных алифатических спиртов и высших прямоцепочечных насыщенных и ненасыщенных одноосновных карбоновых кислот. Причем и кислоты, и спирты обычно содержат четное число углеродных атомов (С16–С36). Кроме того, воски всегда еще содержат свободные кислоты и спирты, а часто и высшие углеводороды. Сложные эфиры восков омылению подвергаются труднее, чем жиры. Они также растворимы в обычных растворителях для жиров. В воде воски нерастворимы. Температуры плавления большинства восков лежат в интервале 40–90 °С, и их можно формовать при нагревании.
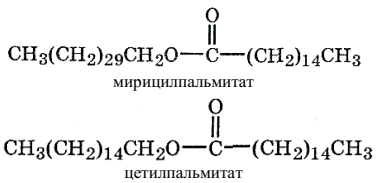
Воски подразделяются на растительные и животные. У растений 80 % от всех липидов составляют воски. Растительные воски обычно содержат, помимо эфиров с большой молекулярной массой, еще и значительное количество насыщенных углеводородов. Примером животных восков служит пчелиный воск, содержащий, кроме высших эфиров, 15 % высших карбоновых кислот С16–С36 и 12–17 % высших углеводородов (С21–С35). Широкое применение находит содержащийся в черепной полости кашалота спермацет, главными компонентами которого являются мирицилпальмитат и цетилпальмитат:
Овечью шерсть покрывает ланолин, представляющий сложную смесь различных восков, кислот и спиртов.
Покрывая тонким слоем листья, стебли, плоды, воски защищают растения от вредителей и болезней, а также от лишней потери воды. Растительные воски применяются в фармакологии, косметике, а также в технике и в быту, например как консерванты для автомобильных кузовов, для натирки полов.
Ланолин, в отличие от других восков, образует устойчивые эмульсии с водой, взятой в количестве, превышающем массу воска в 1,8–2 раза. Животные воски используются в фармакологии и косметике для приготовления различных кремов и мазей, а также для изготовления кремов для обуви.
Омыление жиров с помощью едкого натра или едкого кали проводится главным образом при получении мыла.
Мыла представляют собой щелочные соли высших жирных кислот:
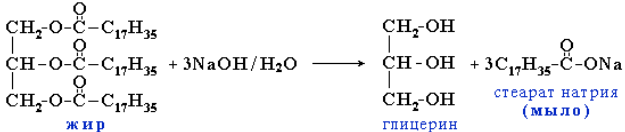
В промышленности в качестве исходных веществ для их получения применяются животные жиры (сало низких сортов), хлопковое, пальмовое, кокосовое масла, гидрогенизированные жиры. При нагревании их с едким натром образуется густой раствор («мыльный клей»), содержащий глицерин и соли жирных кислот. Затем к еще горячей жидкости прибавляют поваренную соль – «высаливают» натриевое мыло.
Натриевые мыла после застывания представляют собой твердую массу и называются ядровыми мылами. Мягкие, или жидкие, мыла являются обычно калиевыми мылами. Их получают из менее ценных жиров (льняного, конопляного масла, ворвани) путем омыления едким кали, но при этом не производят технически слишком дорогого выделения калиевых солей жирных кислот, в результате чего калиевые мыла содержат еще воду и глицерин.
Все мыла, являясь щелочными солями слабых кислот, в воде частично гидролизуются с образованием свободной жирной кислоты и гидроокиси щелочного металла, поэтому их растворы имеют щелочную реакцию:
C17H35COONa + H2O↔C17H35COOH + NaOH.
При добавлении натриевого мыла к жесткой воде ионы кальция и магния замещают ионы натрия, образуя нерастворимые и поэтому не обладающие моющим действием кальциевые и магниевые мыла. Поэтому моющая способность мыла в жесткой воде значительно снижается. В продаже под различными названиями имеются моющие средства (детергенты), заменители мыл, представляющие собой, например, смесь натриевых солей эфиров серной кислоты и высших спиртов (главным образом лаурилового и цетилового): R–OSO3Na, где R – от С10 до С16. Эти соединения (а также часто применяемые для этих целей алкансульфонаты R–SO3Na, где R – от C10 до С16) можно использовать и в жесткой воде, так как они не образуют нерастворимых соединений с кальцием и магнием; они не обладают сильными щелочными свойствами и поэтому не повреждают тканей. Значительные количества детергентов употребляются при флотации руд и в других отраслях промышленности, все детергенты и мыла относятся к классу поверхностно-активных соединений.
Мыла и детергенты представляют собой эмульгирующие вещества, превращающие смесь масла и воды в устойчивую эмульсию. Моющая способность мыл и детергентов зависит от их эмульгирующих свойств, а также от способности понижать поверхностное натяжение. Благодаря эмульгированию находящиеся на коже или на одежде жиры и масла, впитывающие в себя грязь, можно удалить водой. Дестабилизация или стабилизация масляно-водных эмульсий мылами и детергентами называется детергенцией.
Углеводородная часть молекулы мыла, или «хвост», имеет тенденцию растворяться в капле масла, в то время как карбоксильная группа; или «голова», притягивается к водной фазе. Вследствие этого поверхность каждой капли масла приобретает отрицательный заряд и стремится оттолкнуться от других таких же капель масла, что приводит к образованию устойчивой эмульсии.
Молекула любого детергента должна иметь гидрофильную группу, подобную карбоксильной группе, и длинную углеводородную цепь. В зависимости от природы и заряда гидрофильной группы различают анионные и катионные детергенты. Свойства мыла или детергента заметно изменяются и в зависимости от природы противоположно заряженного иона, свободно перемещающегося в водной среде.
Производство детергентов непрерывно растет, а доля мыл в производстве моющих и чистящих средств постоянно сокращается. Это позволит высвободить значительное количество низкокачественных жиров для питания сельскохозяйственных животных.
Жирорастворимые витамины. Витаминами называют низкомолекулярные органические вещества, наличие которых в незначительных количествах необходимо для нормальной жизнедеятельности организма. Роль витаминов заключается в том, что они являются составной частью многих ферментов, а иногда – гормонов. Витамины делят на две большие группы – водорастворимые и жирорастворимые. Рассмотрение жирорастворимых витаминов начнем с витаминов группы D, которые образуются из стероидов.
Витамины группы D образуются в коже млекопитающих из эргостерона и холестерина, в которых под действием солнечного света разрывается связь между атомами С-9 и С-10 кольца В. Наиболее распространены эргокалъциферол (витамин D2) и холекальциферол (витамин D3):
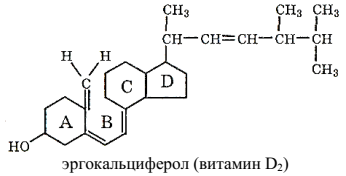
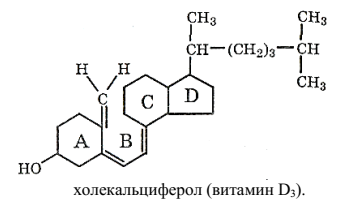
Витамины D малостабильны и быстро разрушаются под действием света, окислителей и минеральных кислот.
Основное количество витаминов D, необходимое человеку, образуется в коже под действием света. При недостаточном образовании витаминов D, особенно в осенне-зимний период, их запасы должны пополняться за счет питания. Источником витаминов D являются рыбий жир, сливочное масло, молоко, желток яйца и печень животных. Витамины D регулируют обмен фосфора и кальция в организме, содействуют всасыванию соответствующих ионов кишечником и формированию костной ткани. При D-авитаминозе развивается рахит, остеопороз и другие болезни костной ткани.
Витамины группы А являются факторами роста. Их недостаток в организме вызывает ослабление зрения, торможение роста, общее истощение и понижение сопротивляемости организма инфекции. Наиболее распространенным считается витамин A1, который также называется ретинолом. Источником витамина A1 для человека являются рыбий жир, печень рыб, птиц и животных, желток яйца, сливочное масло, плоды с оранжевой и красной мякотью (морковь, томаты, перец), а также зелень.
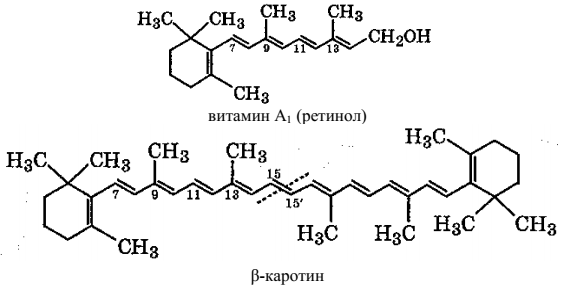
В овощах, фруктах, зелени витамин А1 содержится в виде провитамина β-каротина. Молекула β-каротина в кишечной стенке человека и животных, окисляясь кислородом по двойной межуглеродной связи 15–15', распадается с образованием двух молекул витамина A1. Каротин и витамин А1 являются изопреноидами.
Витамины группы А хорошо растворимы в липофильной части тканей. Они проявляют восстановительные свойства за счет атомов углерода сопряженных двойных связей, выступая антиоксидантами, ограничивающими свободнорадикальное окисление в тканях, и тем самым предотвращают дегенеративные процессы в них.
Витамины группы Е, так называемые α,β,γ-токоферолы, – полиалкильные производные гидрохинона. Благодаря наличию в их молекулах алкильных группировок, витамины Е растворяются в жирах, а за счет гидрохинонового фрагмента выступают восстановителями. Токоферолы – одни из самых сильных природных антиоксидантов. Реагируя с активными формами кислорода и окисляясь в соответствующие хиноны, они обрывают цепи окисления.
Тема 4.2 Углеводы
Углеводы составляют до 80 % сухого вещества растений и около 2 % сухого вещества животных. Следовательно, они принадлежат к наиболее распространенным природным органическим соединениям. Углеводы являются одной из главных составных частей пищевого рациона людей (до 650 г углеводов в день) и многих животных. Они образуются в растениях за счет фотосинтеза в зеленом листе.
Углеводы (сахара)– органические вещества, состав которых выражается формулой Cx(H2O)y, где x и y > 3. Углеводы содержатся в клетках растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. Эти соединения образуются растениями в процессе фотосинтеза из углекислого газа и воды.
Животные организмы не способны синтезировать углеводы и получают их с растительной пищей. Фотосинтез можно рассматривать как процесс восстановления СО2 с использованием солнечной энергии. Эта энергия освобождается в животных организмах в результате метаболизма углеводов, который заключается с химической точки зрения в их окислении.
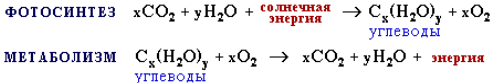
Важнейшими органическими производными являются альдегидо- и кетопроизводные многоатомных спиртов, так называемые углеводы общей формулы Сn(Н2О)m. Они являются теми кирпичиками, из которых построен весь растительный мир, и незаменимыми элементами многих биосистем животных и человека, в частности, нуклеиновых кислот. Они же являются основным источником физической и духовной энергии живого организма. Название углеводы происходит от того, что все альдегидо- и кетоспирты, начиная от простейших, таких как гликолевый альдегид НОС−СН2−ОН и диоксиацетон НО−СН2−СО−СН2ОН, и до самых сложных полисахаридов имеют состав Сn(Н2О)m или Сn(Н2О)m–1, который показывает, что в структуре их молекул нет никаких других сочетаний атомов, кроме углерода и воды. Из-за сладкого вкуса многих углеводов и присутствия среди них таких веществ, как обычный сахар С12Н22О11 они получили название сахаров. Целесообразно начать рассмотрение свойств альдегидо- и кетоспиртов с углеводов. Углеводы можно разделить на простые с общей формулой Сn(Н2О)m и сложные с составом {Сn(Н2О)m–1}х, где х изменяется от двух до десятков тысяч. Соединения состава Сn(Н2О)m носят название моносахаридов и по числу атомов углерода п в молекуле подразделяются на тетрозы С4Н8О4 (например, эритрозы), пентозы С5Н10О5 (например, рибозы), гексозы С6Н12О6 (например, глюкозы и фруктозы). Соединения состава {Сn(Н2О)m–1}x с х = 2 носят название дисахаридов, х = 3 – трисахаридов, х = 4–10 – олигосахаров. Если х велико, то соединения являются полисахаридами. К их числу относятся энергетические углеводы (крахмал, гликоген) и структурные углеводы (целлюлоза), создающие устойчивую структуру растений.
Большинство углеводов, используемых в пищу, под действием ферментов пищеварительного тракта гидролизуются до глюкозы и фруктозы, которые поступают в клетки. По способности к гидролизу углеводы делятся на простые – моносахариды и сложные – олигосахариды и полисахариды. Моносахариды не гидролизуются с образованием более простых углеводов. Сложные углеводы гидролизуются до моносахаридов. В молекулах олигосахаридов содержится от 2 до 10 моносахаридных остатков, в полисахаридах – от 10 до 3000–5000.
Моносахариды – это простейшие сахаристые вещества, сладкие на вкус, растворимые в воде, оптически активные, которые подвергаются брожению и не подвергаются гидролизу. В зависимости от числа атомов кислорода, в большинстве случаев, равного числу углеродных атомов, моносахариды делятся на тетрозы, пентозы, гексозы, гептозы, октозы и т. д. По химическому строению моносахариды относятся к многоатомным оксиальдегидам или оксикетонам. Поэтому различают альдозы и кетозы.
В природе наиболее распространены моносахариды, в молекулах которых содержится пять углеродных атомов (пентозы) или шесть (гексозы). Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных. Например :
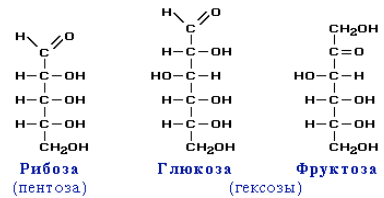
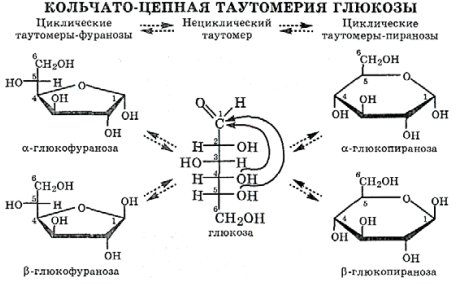
В растворах моносахаридов эти формы находятся в равновесии друг с другом. Например, в водном растворе глюкозы существуют следующие структуры:
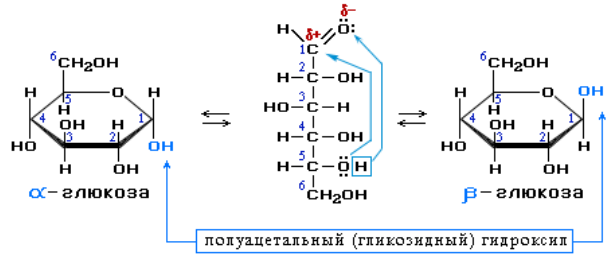
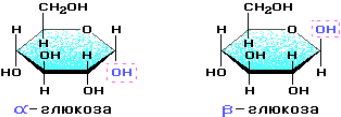
Циклические α- и β-формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. В α-глюкозе этот гидроксил находится в цис-положении к гидроксилу при С2, в β-глюкозе – в транс-положении. С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид:
Аналогичные процессы происходят и в растворе рибозы:
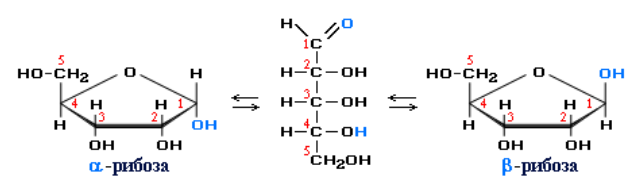
В кристаллическом состоянии моносахариды имеют циклическое строение.
Наибольшее значение в жизненно важных структурах и процессах играют альдопентозы и особенно альдогексозы, например, глюкоза. Она входит в состав свекловичного (тростникового) сахара, крахмала, гликогена и целлюлозы. Основные химические реакции, доказывающие строение глюкозы, приведены на схеме.
Циклическая форма строения легко объясняет ряд особенностей моносахаридов, а именно: неспособность образовывать дисульфитные соединения с дисульфитом натрия и давать характерную окраску с фуксинсернистой кислотой, образование метилгликозидов и явление мутаротации.
Химические свойства моносахаридов обусловливаются наличием карбонильной группы (окисление, восстановление, присоединение и замещение), спиртовых групп (образование сахаратов, простых и сложных эфиров, дегидратация) и гликозидного гидроксила в полуацетальной форме (образование сложных сахаров и гликозидов)
Фруктоза как представитель кетоз. Строение и свойства, отличие от глюкозы. Структурная изомерия (положения карбонильной группы).
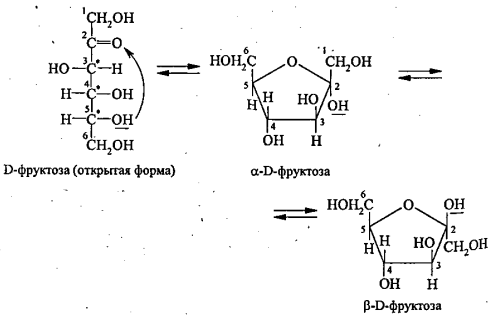
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). Примером наиболее распространенных в природе дисахаридов является сахароза (свекловичный или тростниковый сахар).
Молекула сахарозы состоит из остатков глюкозы и фруктозы, со единенных друг с другом за счет взаимодействия полуацетальных гидроксилов
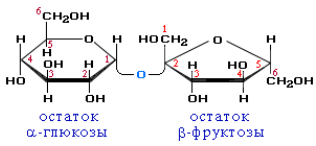
Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала», так как не способна образовывать открытую форму. Подобные дисахариды называют невосстанавливающими, т. е. не способными окисляться.
Для дисахаридов характерна реакция гидролиза, в результате которой образуются две молекулы моносахаридов:
C12H22O11 + H2O → 2C6H12O6.
Сахарозу называют также тростниковым ли свекловичным сахаром. Сахароза отличается от других дисахаридов тем, что содержит фруктофуранозное кольцо и гликозидная связь соединяет аномерные центры обоих сахаров в молекуле сахарозы.
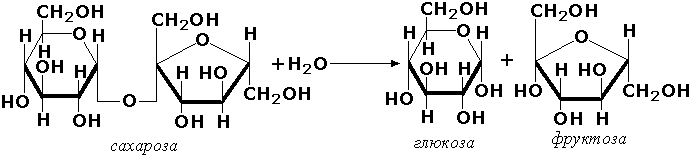
. По типу дисахаридов построены молекулы других олигосахаридов и полисахаридов.
Полисахариды – это природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. Основные представители – крахмал и целлюлоза – построены из остатков одного моносахарида – глюкозы. Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (C6H10O5)n, но совершенно различные свойства. Это обьясняется особенностями их пространственного строения.
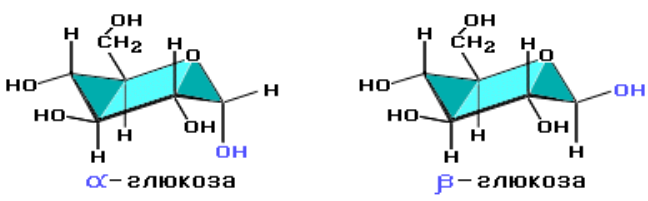
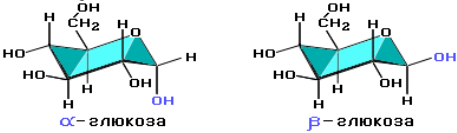
Крахмал состоит из остатков α-глюкозы, а целлюлоза – из β-глюкозы, которые являются пространственными изомерами и отличаются лишь положением одной гидроксильной группы (выделена цветом):
С учетом пространственного строения шестичленного цикла формулы этих изомеров имеют вид:
Крахмалом называется смесь двух полисахаридов, построенных из остатков циклической α-глюкозы.
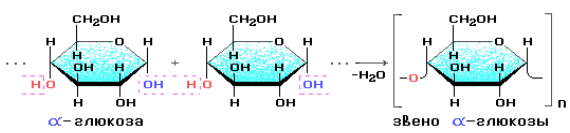
В его состав входят: амилоза (внутренняя часть крахмального зерна) – 10–20 %; амилопектин (оболочка крахмального зерна) – 80–90 %.
Цепь амилозы включает 200–1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
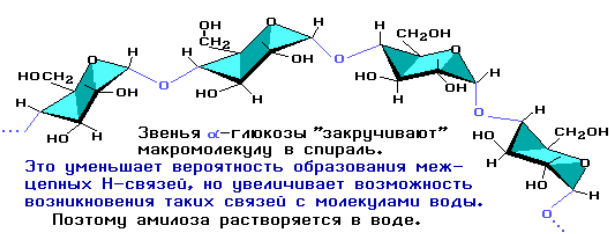
Макромолекула амилозы представляет собой спираль, каждый виток которой состоит из шести звеньев α-глюкозы. При взаимодействии амилозы с иодом в водном растворе молекулы иода входят во внутренний канал спирали, образуя так называемое соединение включения. Это соединение имеет характерный синий цвет. Данная реакция используется в аналитических целях для обнаружения как крахмала, так и иода (иодкрахмальная проба).
Амилопектин состоит из разветвленных макромолекул, молекулярная масса которых достигает 1–6 млн.
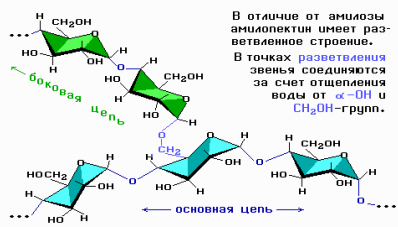
Подобно амилопектину построен гликоген (животный крахмал). Полисахарид гликоген снабжает организм животных глюкозой при повышенных физических нагрузках, а также в промежутках между приемами пищи. Он запасается преимущественно в печени и скелетной мускулатуре. Гликоген очень напоминает амилопектин, но в гликогене степень разветвления значительно выше. Гликоген можно рассматривать как структурный и функциональный аналог растительного крахмала у животных.
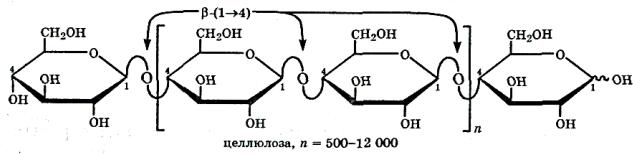
Целлюлоза (клетчатка) – наиболее распространенный растительный полисахарид. Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенку растительных клеток. Используется в производстве волокон и бумаги.
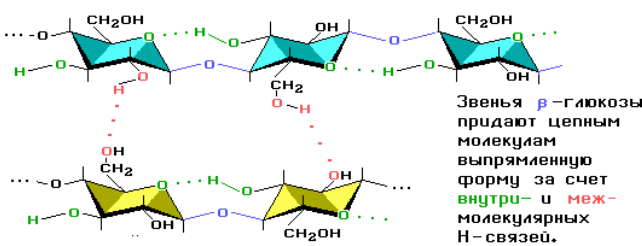
В большом количестве целлюлоза содержится в древесине и хлопке. Цепи целлюлозы построены из остатков β-глюкозы и имеют линейное строение.
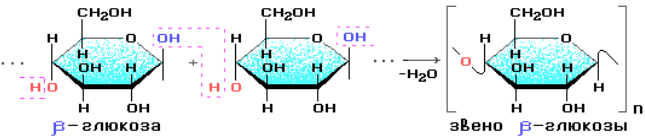
Молекулярная масса целлюлозы – от 400 тыс. до 2 млн. Целлюлоза относится к наиболее жесткоцепным полимерам.
Мукополисахариды относятся к высокомолекулярным гетерополи-сахаридам, образующим комплексные соединения с белками. Они являются основными компонентами слизей (слюны, кишечного сока, суставов). Основными представителями этой группы углеводов являются гепарин, гиалуроновая и хондроитинсерная кислоты.
Дата добавления: 2018-05-10; просмотров: 2227;











