Тема 3.2 Альдегиды и кетоны
Альдегидами и кетонами называются производные углеводородов, содержащие карбонильную группу, или оксогруппу. В альдегидах, как правило, карбонильная группа связана одной из своих свободных валентностей с атомом водорода, другой – с каким-либо углеводородным радикалом. Все альдегиды содержат группу СОН, называемую альдегидной. В кетонах карбонильная группа двумя своими валентностями соединена с какими-либо углеводородными радикалами. Альдегиды и кетоны бывают насыщенными, ненасыщенными и ароматическими. Предельные альдегиды и кетоны с одинаковым числом углеродных атомов изомерны друг другу и имеют одну и ту же суммарную формулу.
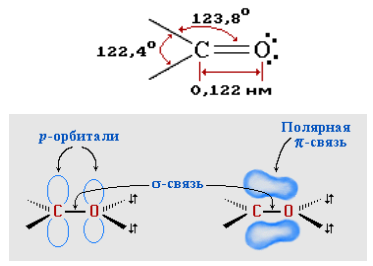
Рисунок 3.3 – Строение карбонильной группы
Альдегиды называют или по кислотам, в которые они переходят при окислении (тривиальная номенклатура), или по названию предельных углеводородов с добавлением окончания -аль (систематическая номенклатура IUРАС). Кетоны по рациональной номенклатуре называют по названию радикалов, входящих в их молекулу, с добавлением окончания -кетон. По систематической номенклатуре IUРАС кетоны называют по названию соответствующего углеводорода с добавлением окончания -он и с указанием местонахождения карбонильной группы.
Наличие карбонильной группы обусловливает высокую реакционную активность альдегидов и кетонов и определяет их способность к многочисленным и разнообразным реакциям.
Альдегиды легко окисляются до карбоновых кислот с тем же углеродным скелетом.
1. Они могут окисляться даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор гидроокиси серебра:
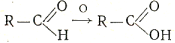
2. Реакцию альдегидов с аммиачным раствором гидроокиси серебра называют «реакцией серебряного зеркала» – окисление аммиачным раствором оксида серебра (реактив Толленса). Ее используют для обнаружения альдегидов:
R–CH=O + 2[Ag(NH3)2]OH → RCOOH + 2Ag↓ + 4NH3 + H2O.
Кетоны не окисляются ни кислородом воздуха, ни слабыми окислителями, не восстанавливают аммиачный раствор гидроокиси серебра. Они окисляются лишь под действием более сильных окислителей, например, перманганата калия, причем окисление происходит иначе, чем окисление альдегидов. При окислении молекула кетона расщепляется с образованием молекул кислот или кислоты и кетона с меньшим числом углеродных атомов, чем первоначальный. Разрыв цепи углеродных атомов происходит рядом с карбонильным атомом углерода:
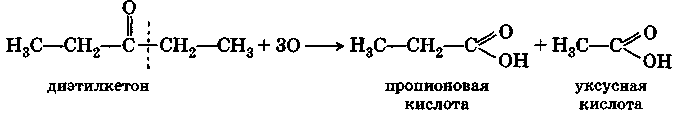
Если в молекуле кетона содержится два различных радикала, то распад молекулы при окислении может идти по двум возможным направлениям, например:
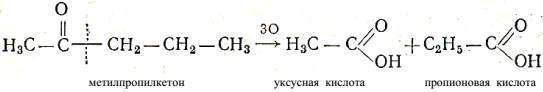
Таким образом, произведя окисление кетона и узнав, какие кислоты получились в результате окисления, можно определить строение кетона.
3. Реакция окисления гидроксидом меди(II):
а) в виде свежеприготовленного осадка Cu(OH)2 при нагревании;
б) в форме комплекса с аммиаком [Cu(NH3)4](OH)2;
в) в составе комплекса с солью винной кислоты (реактив Фелинга).
При этом образуется красно-кирпичный осадок оксида меди(I) или металлическая медь (реакция «медного зеркала», более характерная для формальдегида):
R–CH=О + 2Cu(OH)2 → RCOOH + Cu2O↓ + H2О;
H2C=О + Cu(OH)2 → HCOOH + Cu↓ + H2О;
R–CH=O + 2[Cu(NH3)4](OH)2 → RCOOH + Cu2O↓ + 4NH3 + 2H2O;
R–CH=O + 2Cu(OH)2/соль винной кислоты → RCOOH + Cu2O↓ + 2H2O.
При нагревании наблюдают появление осадка оксида меди(I) желтого цвета, переходящего в красный:
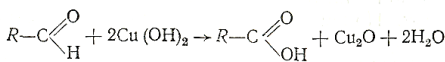
Муравьиный альдегид, в отличие от других альдегидов, восстанавливает оксиды меди, образуя «медное зеркало».
4. Реакция восстановления альдегидами реактива Фелинга.
Реакционную смесь нагревают. При этом раствор сначала окрашивается в зеленый, а затем в желтый цвет, и наконец, выпадает оксид меди (I) красного цвета:
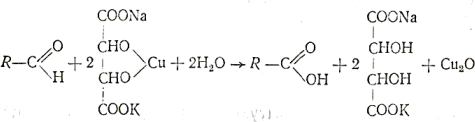
5. Цветная реакция на альдегиды с фуксиксернистой кислотой: наблюдается постепенное появление красно-фиолетовой окраски. Если к смеси муравьиного альдегида с фуксинсернистой кислотой прибавлять концентрированную соляную кислоту, то появляется характерная синяя окраска. В смеси изовалерианового альдегида с фуксинсернистой кислотой под влиянием соляной кислоты окраска сравнительно быстро исчезает.
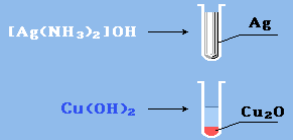
Рисунок 3.4 – Качественные реакции на альдегидную группу
Как альдегиды, так и кетоны могут присоединять водород, синильную кислоту, магний-органические соединения, гидросульфит натрия.
С гидроксиламином и фенилгидразином альдегиды и кетоны реагируют с образованием оксимов и фенилгидразонов; при действии пятихлористого фосфора атом кислорода в молекулах альдегидов и кетонов замещается двумя атомами хлора.
Однако между альдегидами и кетонами имеются и существенные различия. Так, в отличие от альдегидов кетоны не окрашивают бесцветный раствор фуксинсернистой кислоты, в мягких условиях не конденсируются под действием щелочей, за редкими исключениями, и дают со спиртами ацетали только в присутствии кислот Льюиса. Из кетонов с гидросульфитом натрия реагируют только те, которые содержат одну метильную или две метиленовые группы в непосредственном соседстве с карбонилом.
Окисляются кетоны труднее, чем альдегиды, причем при их окислении происходит разрушение молекулы, труднее для кетонов протекают и реакции конденсации.
Применение альдегидов и кетонов.
Метаналь (муравьиный альдегид) CH2=O: получение фенолформальдегидных смол; получение мочевино-формальдегидных (карбамидных) смол; полиоксиметиленовые полимеры; синтез лекарственных средств (уротропин); дезинфицирующее средство; консервант биологических препаратов (благодаря способности свертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О: производство уксусной кислоты; органический синтез.
Ацетон СН3–СО–СН3: растворитель лаков, красок, ацетатов целлюлозы; сырье для синтеза различных органических веществ.
Дата добавления: 2018-05-10; просмотров: 2435;











