Тема 3.1 Спирты и фенолы
Существует огромное число органических соединений, в состав которых наряду с углеродом и водородом входит кислород. Атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к конкретному классу.
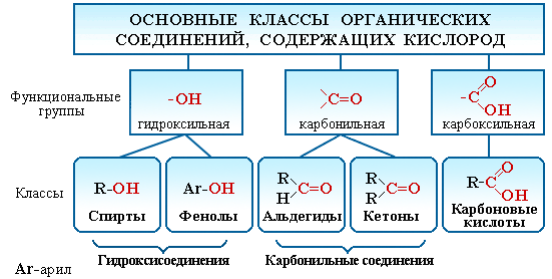
Рисунок 3.1 – Классификация органических соединений, содержащих кислород
Соединения каждого класса образуют различные производные. Например, к производным спиртов относятся простые эфиры ROR', к производным карбоновых кислот – сложные эфиры RCOOR', амиды RCONH2, ангидриды (RCO)2O, хлорангидриды RCOCl и т. д.
Кроме того, большую группу составляют гетерофункциональные соединения, содержащие различные функциональные группы:
- гидроксиальдегиды HO–R–CHO;
- гидроксикетоны HO–R–CO–R';
- гидроксикислоты HO–R–COOH и т. п.
Спирты – соединения алифатического ряда, содержащие одну или несколько гидроксильных групп. Общая формула спиртов с одной гидроксигруппой – R–OH. Спирты классифицируют по различным структурным признакам.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа –ОН), многоатомные (две и более групп –ОН).
Современное название многоатомных спиртов – полиолы (диолы, триолы и т. д.).
Примеры:
- двухатомный спирт – HO–СH2–CH2–OH этиленгликоль (этандиол);
- трехатомный спирт – HO–СH2–СН(ОН)–CH2–OH глицерин (пропантриол-1,2,3).
В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты:
- первичные R–CH2–OH;
- вторичные R2CH–OH;
- третичные R3C–OH.
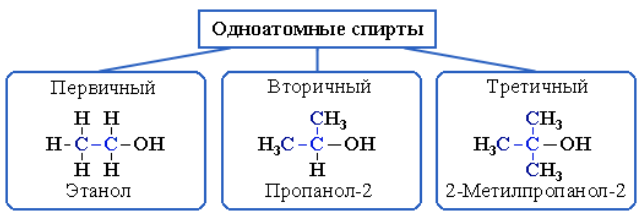
Рисунок 3.2 – Классификация одноатомных спиртов
В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются следующим образом:
- предельные, или алканолы (например, СH3CH2–OH);
- непредельные, или алкенолы (CH2=CH–CH2–OH);
- ароматические (C6H5CH2–OH).
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо).
Например:
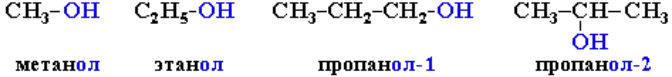
Нумерация ведется от ближайшего к ОН-группе конца цепи. Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса -ол. Это разгружает словесную часть названия от цифр (например, 2-метилбутанол-1). В англоязычной литературе цифру ставят перед названием главной цепи: 2-метил-1-бутанол.
Правила IUPAC разрешают учитывать особенности национального языка. По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова «спирт». В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт. В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т. д. Например:

Для спиртов характерна структурная изомерия:
- изомерия положения ОН-группы (начиная с С3):
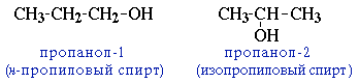
- углеродного скелета (начиная с С4); например, формуле C4H9OH соответствует 4 структурных изомера:
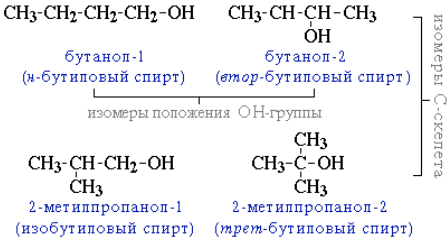
- межклассовая изомерия с простыми эфирами (например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3).
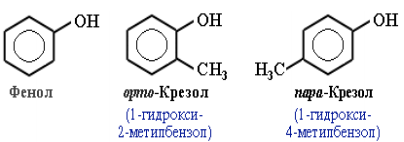
Фенолы – гидроксисоединения, в молекулах которых ОН-группы связаны непосредственно с бензольным ядром.
Основные способы получения спиртов и фенолов:
1. Щелочной гидролиз галогенуглеводородов:
CH3–Br + NaOH (водн.) → CH3–OH + NaBr;
ClCH2–CH2Cl + 2 NaOH (водн.) → HOCH2–CH2OH + 2NaCl;
C6H5Cl + NaOH (p, 340°С) → C6H5OH + NaCl.
2. Гидратация алкенов:
CH2=CH2 + H2O (кат.) → CH3CH2OH.
Присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов:
CH3–CH=CH2 + H2O (кат.) → CH3CH(OH)CH3;
(CH3)2C=CH2 + H2O (кат.) → (CH3)3C–OH.
3. Гликоли получают окислением алкенов щелочным раствором KMnO4:
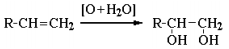
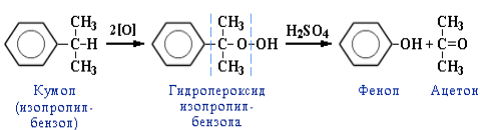
4. Кумольный способ получения фенола. Преимущества метода: безотходная технология (выход полезных продуктов более 99 %) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола:
Химические свойства спиртов и фенолов.
Реакции по связи О–Н. Легкость этих реакций и строение образующихся продуктов зависят от строения углеводородного радикала и взаимного влияния атомов. Реакционная способность одноатомных спиртов в реакциях по связи
О–Н: CH3OH > первичные > вторичные > третичные. К наиболее характерным реакциям гидроксисоединений, идущим с разрывом связи О–Н, относятся:
1. Реакции замещения атома водорода на металл (кислотные свойства) – одноатомные спирты реагируют с активными металлами (Na, K, Mg, Al и др.), образуя соли – алкоголяты:
2R–OH + 2Na → 2RO–Na + H2;
2C2H5OH + 2K → 2C2H5O–K + H2.
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т. п.) являются более сильными кислотами, чем одноатомные спирты. Такие спирты в отличие от одноатомных взаимодействуют с раствором гидроксида меди(II) в присутствии щелочи, образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):
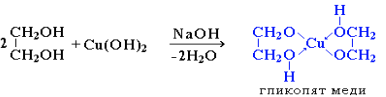
Фенолы являются более сильными кислотами, чем спирты и вода, так как за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты:
C6H5OH+NaOH →C6H5ONa + H2O.
Для обнаружения фенолов используется качественная реакция с хлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
2. Реакции замещения атома водорода на остаток кислоты (образование сложных эфиров). Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
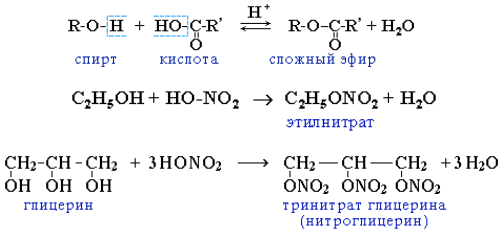
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным. Фенолы не образуют сложные эфиры в реакциях с кислотами.
При межмолекулярной дегидратации спиртов также происходит замещение ОН-группы в одной молекуле спирта на группу OR другой молекулы:
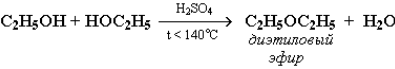
3. Реакции отщепления водорода при окислении и дегидрировании. Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная или межмолекулярная реакция. Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре:
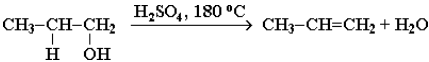
В тех случаях, когда возможны два направления реакции, например:
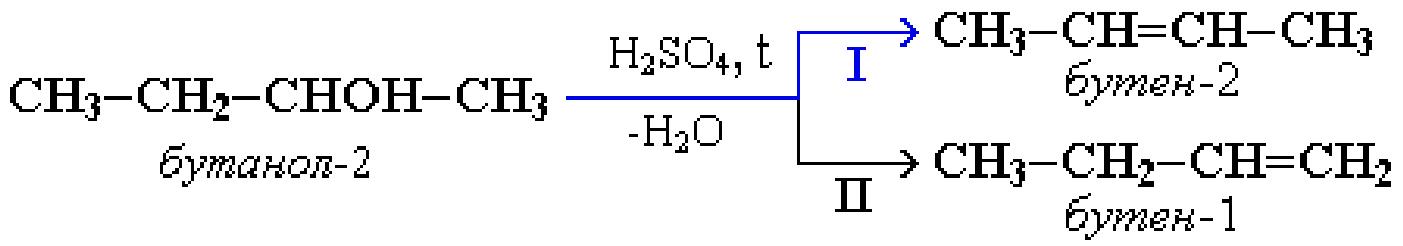
дегидратация идет преимущественно в направлении I, т. е. по правилу Зайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно в орто- и пара- положениях:
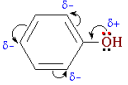
Поэтому фенол значительно активнее бензола вступает в реакции замещения в ароматическом кольце.
4. Нитрование. Под действием 20%-ной азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
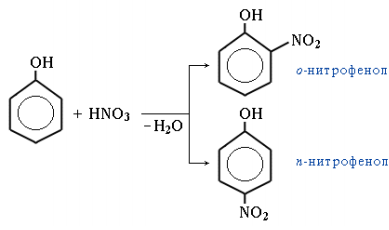
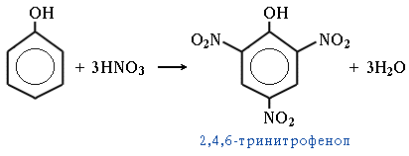
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
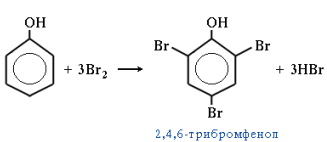
5. Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
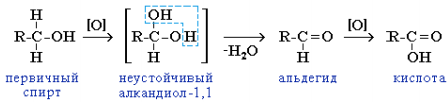
6. Реакции окисления. Окислители – KMnO4, K2Cr2O7+H2SO4, O2 + катализатор. Легкость окисления спиртов уменьшается в ряду: первичные ≥ вторичные >> третичные. Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот:
При окислении вторичных спиртов образуются кетоны:
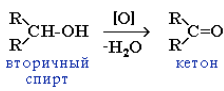
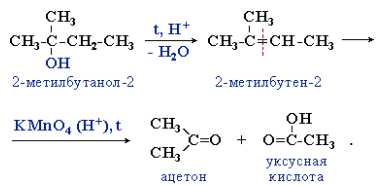
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой). Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислением алкена. Например:
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например: 2CH3OH + 3O2 → 2CO2 + 4H2O.
Полное окисление метанола идет по схеме:
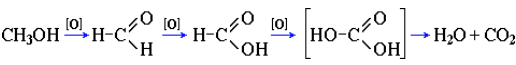
При сгорании спиртов выделяется большое количество тепла.
C2H5OH + 3O2 → 2CO2 + 3H2O + 1370 кДж.
Благодаря высокой экзотермичности реакции горения этанола он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторной практике этанол применяется как горючее для спиртовок.
Двухатомные и трехатомные спирты. Взаимодействие этиленгликоля с металлическим натрием. Реакция сопровождается выделением тепла:
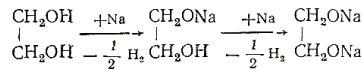
Образуются неполный и полный гликоляты натрия. После полного растворения натрия, образовавшиеся гликоляты разлагают водой. Раствор испытывают фенолфталеином, в результате чего появляется характерная окраска малинового цвета.
Образование гликолята и глицерата меди:
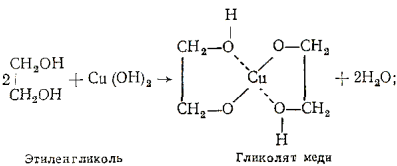
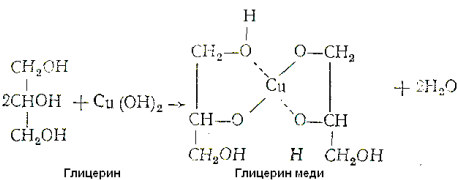
Одноатомный этиловый спирт с гидроксидом меди не реагирует. Способность растворять гидроксид меди(II) является характерной особенностью многоатомных спиртов.
Дегидратация глицерина
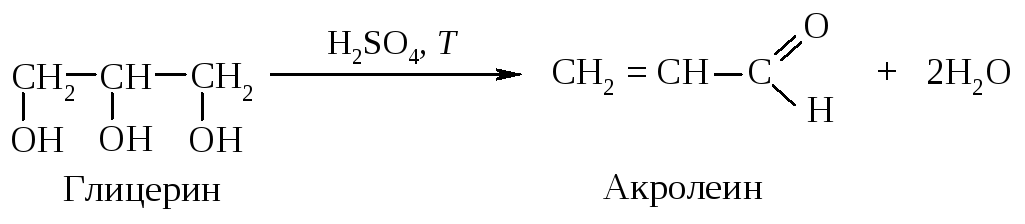
Неприятный запах, возникающий при подгорании жира, объясняется также образованием акролеина из глицерина, который входит в состав жиров.
Метанол (метиловый спирт) CH3OH используется в производстве формальдегида, муравьиной кислоты и как растворитель. Этанол (этиловый спирт) С2Н5ОН находит применение в производстве ацетальдегида, уксусной кислоты, бутадиена, простых и сложных эфиров; а также используется как растворитель для красителей, лекарственных и парфюмерных средств; в производстве ликероводочных изделий; как дезинфицирующее средство в медицине; в качестве горючего для двигателей, добавки к моторным топливам.
Этиленгликоль HOCH2–CH2OH является компонентом в производстве пластмасс, антифризов и сырьем в органическом синтезе.
Глицерин HOCH2–CH(OH)–CH2OH применяют в фармацевтической и парфюмерной промышленности; как смягчитель кожи и тканей; в производстве взрывчатых веществ.
Фенол C6H5OH используют для производства фенолформальдегидных смол и как полупродукт в органическом синтезе красителей, лекарственных препаратов, средств защиты растений.
Дата добавления: 2018-05-10; просмотров: 4070;











