Отдельные представители.
Муравьиная кислота(метановая) - HCOOH. Особенность муравьиной кислоты состоит в том, что это вещество – бифункциональное соединение, оно одновременно является и карбоновой кислотой, и альдегидом:
Поэтому муравьиная кислота реагирует и с аммиачным раствором оксида серебра (реакция серебряного зеркала, которая является качественной реакцией на альдегиды).
HCOOH + Ag2O(амм. р-р) → CO2 + H2O + 2Ag
По физическим свойствам муравьиная кислота – это бесцветная подвижная жидкость с резким запахом, Т пл = 8,25 °C,
T кип = 100,7 °С, плотность 1,220 г/см3. Муравьиная кислота смешивается с водой, спиртом, эфиром. Ее молекулы не связаны в единый пространственный каркас, а объединены водородными связями попарно. Отсюда следует невысокая вязкость и заметная летучесть муравьиной кислоты:
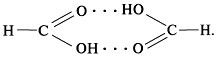
По химическим свойствам муравьиная кислота самая реакционноспособная из всех карбоновых кислот. Это объясняется тем, что ее карбоксильная группа связана с водородом, а не с углеводородным радикалом. Благодаря присутствию в молекуле альдегидной группы муравьиная кислота обладает свойствами альдегидов.Соли муравьиной кислоты называют формиатами.
Впервые муравьиная кислота была открыта в 1670 г. английским естествоиспытателем Джоном Реем в выделениях муравьев, откуда и пошло это название. Об открытии Ю.Либихом безводной муравьиной кислоты мы знаем по воспоминаниям его ученика – К.Фогта. Около 70% содержимого ядовитой железы рыжего муравья – это муравьиная кислота. Муравьиная кислота содержится также в листьях крапивы (вызывает ожоги), в хвое ели. Издавна люди использовали муравьиную кислоту как средство для лечения ревматизма. Люди, страдающие подагрой, засовывали ноги в муравейник и некоторое время терпели укусы его обитателей. Иногда использовали крапиву. В начале XVIII в. ученые научились вовлекать муравьиную кислоту в реакции с различными спиртами, получая вещества с узнаваемыми запахами. Например, в реакции фенилэтилового спирта и муравьиной кислоты получали вещество с запахом хризантем; при нагревании бензилового спирта с муравьиной кислотой получали вещество с запахом жасмина.
Муравьиная кислота находит широкое применение в различных отраслях народного хозяйства. В технике кислоту и ее соли применяют в качестве протравы при крашении тканей, в кожевенном производстве – для отмывания извести, используемой при обработке шкур. В медицине смесь кислоты с водой, так называемый муравьиный спирт, используется как раздражающее кожу, рефлекторно действующее средство при ревматических и неврологических болях. Муравьиная кислота применяется в промышленном органическом синтезе в качестве восстановителя, а также для получения щавелевой кислоты. В пищевой отрасли промышленности ее используют в качестве дезинфицирующего и консервирующего средства. Сложные эфиры муравьиной кислоты используют в качестве растворителей и душистых веществ. Муравьиная кислота обладает бактерицидным действием.
Уксусная кислота – CH3COOH. Одноосновная карбоновая кислота жирного ряда. По химическим свойствам уксусная кислота уступает муравьиной, что является результатом влияния радикала СН3 на карбоксильную группу:
Уксусная кислота известна с древнейших времен (Китай, Египет, Вавилон) и была, очевидно, первой кислотой, которую узнал человек. Кислоту выделяли из уксуса, а последний получался при скисании вина. В 1648 г. немецкий химик И.Р.Глаубер обнаружил уксусную кислоту в подсмольной воде сухой перегонки дерева. В 1789 г. русский химик Т.Е.Ловиц впервые получил кристаллическую, так называемую ледяную уксусную кислоту. Ее химический состав был определен в 1814 г. шведским химиком Й.Я.Берцелиусом. Первый лабораторный синтез уксусной кислоты был осуществлен в 1845 г. немецким химиком А.В.Г.Кольбе. Уксусная кислота широко распространена в природе. Она содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в частности, в зеленых листьях). Эта кислота встречается как в свободном виде, так и в виде солей и эфиров, она присутствует в кислом молоке и сыре.
Уксусная кислота образуется при брожении, гниении, скисании вина и пива, при окислении многих органических веществ. В промышленности из ацетилена по реакции Кучерова получают уксусный альдегид (ацетилен получают из доступного сырья – метана), окисление альдегидадает кислоту.
Уксусная кислота – жидкость, кислая на вкус, с резким запахом. Безводная уксусная кислота плавится при +16,6 °С, ее кристаллы прозрачны как лед, отсюда название ледяная уксусная кислота. Обычная техническая уксусная кислота имеет концентрацию 70–80%. Температура кипения 100%-й уксусной кислоты – 118 °C. Смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
Уксусную кислоту используют при консервации и как приправу к пище. Из уксусной кислоты синтезируют лекарства, соли, ацетатный шелк, фруктовые эссенции, растворители лаков, красители для тканей, средства борьбы с насекомыми и болезнями растений, стимуляторы роста растений. Уксусный ангидрид применяется в производстве пластических масс, искусственного шелка, ацетанилида. Из монохлоруксусной кислоты получают негорючую кинопленку, органическое стекло, пропускающее ультрафиолетовые лучи. В результате применения 2,4-дихлорфеноксиуксусной кислоты и ее солей на полях с зерновыми погибают только широколиственные сорняки, что используется при выращивании зерновых культур.
Стеариновая - С17Н35СООН и пальмитиновая - С15Н31СООН кислоты.Эти кислоты в виде сложных эфиров входят в состав жиров, поэтому их называют высшими жирными кислотами.
Мишель Эжен Шеврель совместно с А.Браконно установил, что большинство жиров состоит из стеарина и олеина, выделил стеариновую и пальмитиновую кислоты.
Пальмитиновая кислота – наиболее распространенная в природе жирная кислота, входит в состав глицеридов большинства животных жиров и растительных масел (например, пальмовое масло содержит 39–47% пальмитиновой кислоты), а также в состав некоторых восков.
Кислоты представляют собой твердые вещества, белого цвета, нерастворимы в воде, умеренно растворимы в спирте, эфире, хлороформе и других органических растворителях. Температура плавления стеариновой кислоты +69,3 °С, температура кипения от 360 до 370 °С.
Химические свойства жирных кислот имеют свои особенности. Окраска водных растворов индикаторов не изменяется при добавлении порошков пальмитиновой и стеариновой кислот. Эти кислоты растворяются в водных растворах едких щелочей и карбонатов, образуя соли. Натриевые и калиевые соли высших жирных кислот называют мылами. Они хорошо растворяются в воде, обладают моющим действием и составляют основу жидкого мыла (калиевые соли) и твердого мыла (натриевые соли). Водные растворы мыла имеют щелочную реакцию, т. к. соли подвергаются гидролизу.
Смесь пальмитиновой и стеариновой кислот используют для изготовления стеариновых свечей, мыла, олифы, смазок и других веществ. Жирные кислоты превращают в соли и используют для получения различных мыл. Жидкое мыло (калиевые соли) по сравнению с твердым (натриевые соли) лучше растворимо в воде и поэтому обладает более сильным моющим действием.
Аспирин - сложный эфир салициловой кислоты. При нагревании с водой происходит реакция гидролиза, в результате образуются две кислоты – салициловая и уксусная:
Дата добавления: 2021-10-28; просмотров: 554;











