Прямые методы введения карбоксильной группы.
5.6.1. Оксосинтез. Процесс проводят при температуре 400оС и давлении 200 атм. Катализаторами процесса могут являться тетракарбонилы никеля.
CH3-CH=CH2 + CO + H2O → CH3CH2CH2COOH +
масляная кислота
+ CH3CH(CH3)COOH
изомасляная кислота
5.6.2. Реакция Фридела-Крафтса.
[AlCl3]
C6H6 + COCl2 → C6H5-COOCl + H2O → C6H5-COOH
бензол фосген
5.7. Одновременное введение карбоксильной группы и двойной связи.
(CH3)2CH=O + HCN → CH2=C(CH3)-COOH
5.8. Получение из натуральных продуктов.Некоторые карбоновые кислоты получают из природных продуктов. Так, щелочным гидролизом (омылением) жиров получают соли высших жирных кислот (мыла) и глицерин. Лимонную кислоту получают из ботвы хлопчатника и из стеблей махорки (после выделения из них никотина). Многие карбоновые кислоты получают сбраживанием углеводов в присутствии бактерий определённого вида (маслянокислое, молочнокислое, лимоннокислое и др. виды брожения).
6. Особенности химического строения и химические свойства.
Карбоксильная группа 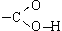 (сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
(сокращенно —COOH) - функциональная группа карбоновых кислот - состоит из карбонильной группы и связанной с ней гидроксильной группы.
В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами π-связи карбонильной группы, в результате чего возрастает полярность связи O-H, упрочняется π-связь в карбонильной группе, уменьшается частичный положительный заряд ( 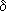 +) на атоме углерода и увеличивается частичный отрицательный заряд (
+) на атоме углерода и увеличивается частичный отрицательный заряд ( 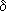 -) на атоме водорода.
-) на атоме водорода.
Последнее способствует образованию прочных водородных связей между молекулами карбоновых кислот.
Упрочнение π-связи в карбонильной группе приводит к тому, что реакции присоединения для карбоновых кислот нехарактерны.
6.1.Горение:
CH3COOH + 2O2 → 2CO2 + 2H2O
6.2. Кислотные свойства. Кислотные свойства обусловлены способностью карбоновых кислот к диссоциации в водном растворе из-за высокой полярности связи O-H:
RCOOH ↔ RCOO- + H+
Как правило, карбоновые кислоты слабее минеральных. Сила карбоновой кислоты существенно зависит от электрофильности радикала, связанного с карбоксилом. Введение электроотрицательных заместителей (например, NO2, CN, Cl) в положение, соседнее с карбоксильной группой, резко повышает кислотность, например, циануксусная кислота CNCH2COOH примерно в 200 раз сильнее уксусной кислоты CH3COOH. По мере удаления от карбоксила влияние заместителей ослабевает.
Дикарбоновые кислоты сильнее монокарбоновых, причём влияние одного карбоксила на другой тем больше, чем они ближе расположены друг к другу. Так, например, в ряду кислот щавелевая кислота HOOC-COOH сильнее малоновой кислоты HOOC-CH2-COOH, которая, в свою очередь, сильнее янтарной кислоты HOOC-(CH2)2-СOOH, и т.д. Кислотность непредельных кислот выше, чем предельных; влияние двойной связи тем сильнее, чем она ближе расположена к карбоксилу. Так, акриловая кислота CH2=CH-СООН в 4 раза сильнее пропионовой CH3-CH2-COOH.
Ароматические кислоты сильнее предельных алифатических.
Карбоновые кислоты проявляют все свойства, присущие слабым кислотам:
Mg + 2CH3COOH → (CH3COO)2Mg + H2
CaO + 2CH3COOH → (CH3COO)2Ca + H2O
NaOH + CH3COOH → CH3COONa + H2O
K2CO3 + 2CH3COOH → 2CH3COOK + H2O + CO2
Этерификация
Реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира. При взаимодействии карбоновых кислот со спиртами в присутствии минеральных кислот легко образуются сложные эфиры:
R–COOH + R'–OH → R–COO-R' + H2O
В реакцию этерификации могут вступать и многоатомные спирты, например, глицерин. Сложные эфиры, образованные глицерином и высшими карбоновыми кислотами (жирными кислотами) - это жиры.
| глицерин | карбоновые кислоты | триглицерид |
Жиры представляют собой смеси триглицеридов. Предельные жирные кислоты (пальмитиновая C15H31COOH, стеариновая C17H35COOH) образуют твердые жиры, которые содержатся в продуктах животного происхождения, а непредельные (олеиновая C17H33COOH, линолевая C17H31COOH и др.) - жидкие жиры (масла) растительного происхождения.
Дата добавления: 2021-10-28; просмотров: 463;











