Термохимические законы
1.Закон Лавуазье-Лапласа
Тепловой эффект реакции образования какого-либо химического соединения равен тепловому эффекту разложения этого соединения с обратным знаком, например:
1/2H2 (г) + 1/2Сl2(г) ® HCl(г); DH°298 (HCl) = – 92 кДж
HCl(г) ® 1/2H2 (г) + 1/2Сl2(г); DH°298 = + 92 кДж.
2.Закон Гесса
Основной закон термохимии был сформулирован русским ученым Г. И. Гессом (1940 г.):
Тепловой эффект химической реакции определяется лишь начальным и конечным состоянием системы и не зависит от пути перехода системы из первого состояния во второе.
Наиболее важно следствие из закона Гесса: тепловой эффект реакции равен сумме энтальпий образования, (DH) продуктов реакции за вычетом суммы теплот образования исходных веществ.
DH = 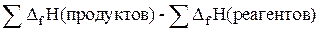
Для реакции в общем виде аА + bB ® cC + dD
Если в уравнении реакции имеются стехиометрические коэффициенты, их необходимо учитывать при суммировании.
DH = [c DH(C) + d DH (D)] – [a DH(A) + b DH(B)]
Пример: Вычислить тепловой эффект реакции горения бензола по стандартным энтальпиям образования
С6Н6(ж) + 7/2О2(г) = 6СО2(г) + 3Н2О(ж)
DH°298 40,6 0 – 394,7 – 286
Воспользуемся следствием из закона Гесса:
DH° = 6DH°(СО2(г)) + 3DH°( Н2О(ж)) – DH°( С6Н6(ж)),
DH° = 6(– 394,7) +3 (– 286) – (+ 40,6) = – 3186,8 кДж.
Энтропия
Вследствие теплого движения частицы (атомы, ионы, молекулы) стремятся изменить свое состояние (смешаться, рассеяться, продифундировать) – система стремится перейти из упорядоченного состояния в состояние с большим беспорядком. Количественной мерой беспорядка является энтропия.
Энтропия системы – S  [Дж/(моль×К)] – мера неупорядоченности ее состояния.
[Дж/(моль×К)] – мера неупорядоченности ее состояния.
Энропия связана с термодинамической вероятностью реализации данного состояния вещества соотношением:
S = k lnW,
где k – постоянная Больцмана; W – термодинамическая вероятность, т. е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
В изолированных системах изменение энтропии служит критерием, определяющим направление процесса. Согласно второму началу термодинамики, в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т. е. DS > 0.
В закрытых системах энтропия в ходе процессов может как увеличиваться, так и уменьшаться. Увеличение энтропии происходит при переходе системы из более упорядоченного состояния в менее упорядоченное.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при увеличении объема газа, при химических взаимодействиях, приводящих к увеличению числа частиц.
Процессы, для которых DS > 0:
1)расширение газов;
2)фазовые превращения, в ходе которых вещество переходит от твердого к жидкому и газообразному состоянию;
Sтв.в. < Sжид. < Sгаз
SН2О (пар) = 183 Дж/(моль×К)
SН2О (жидк.) = 69 Дж/(моль×К)
SН2О (лед) = 43,89 Дж/(моль×К)
3)растворение кристаллических веществ.
Все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие), сопровождаются уменьшением энтропии.
Процессы, для которых DS < 0:
1)сжатие газов;
2)конденсация и кристаллизация веществ.
В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул по мере усложнения состава молекул:
Вещество S 
HF 173,5
HCl 186,4
HBr 198,1
HI 206,5
Энтропия, как и энтальпия, – функция состояния системы, поэтому изменение энтропии DS в ходе превращения системы определяется только начальным и конечным состоянием системы и не зависит о пути протекания процесса.
S  =
= 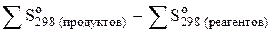
Для химической реакции в общем виде аА + bB ® cC + dD
DS 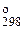 = сS(С) + dS(D) – aS(A) – bS(B).
= сS(С) + dS(D) – aS(A) – bS(B).
Изменение энтропии в ходе реакции образования соединения из простых веществ называют энтропией образования соединения.
Стандартная энтропия образования простых веществ не равна нулю:
Пример. Предскажите знак изменения энтропии (DS 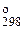 ) в каждой из предлагаемых реакций:
) в каждой из предлагаемых реакций:
1)2KClO3(к) = 2KCl(к) + 3О2(г)
2)N2(г) + 2О2(г) = 2NO2(г)
3)C2Н2(г) = С6Н6(ж)
Решение.
1) DS 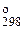 > 0, из кристаллического вещества в ходе реакции образуется газообразное, мера неупорядоченности возрастает.
> 0, из кристаллического вещества в ходе реакции образуется газообразное, мера неупорядоченности возрастает.
2)DS 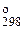 < 0, так как вступают три объема газов, а получаются два, т. е. число частиц газообразных веществ уменьшается, в системе растет упорядоченность.
< 0, так как вступают три объема газов, а получаются два, т. е. число частиц газообразных веществ уменьшается, в системе растет упорядоченность.
3)DS 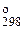 < 0, из газа образуется жидкость – в системе растет упорядоченность.
< 0, из газа образуется жидкость – в системе растет упорядоченность.
Дата добавления: 2017-11-21; просмотров: 2498;











