Направление химических реакций. Энергия Гиббса.
Изменение энтальпии в ходе химической реакции не служит критерием ее направления. Самопроизвольно могут протекать как экзотермические, так и эндотермические реакции, хотя при обычных условиях последние ни менее многочисленны.
Химические процессы характеризуются своим потенциалом, который является движущей силой химических процессов, протекающих при р, Т = const. Его принято называть изобарно–изотермическим потенциалом, или просто изобарным потенциалом. Его обозначают буквой G в честь американского ученого Гиббса, который ввел в термодинамику эту функцию. В его же честь эту величину принято также называть энергией Гиббса DG [кДж/моль].
DG = DН – ТDS
Энергия Гиббса – функция состояния системы, является критерием самопроизвольного протекания химической реакции.
Если DG < 0 – процесс термодинамически возможен (самопроизвольная реакция);
DG > 0 – процесс термодинамически невозможен;
DG = 0 – система находится в состоянии химического равновесия.
Чем более отрицательно значение DG , тем дальше система от состояния равновесия, тем более она реакционноспособна.
В зависимости от температуры влияние энтальпийного фактора DН и энтальпийного ТDS фактора на направление протекания процесса и знак DG показано в таблице:
Таблица.
| Тип реакции | Знак | Принципиальная возможность и условия протекания реакции | ||
| DН | DS | DG | ||
| – | + | – | Прямая реакция может быть самопроизвольной при любых температурах. | |
| – | – | – Т1<Тр + Т2>Тр | Самопроизвольно может идти реакция при низких температурах и обратная реакция при высоких температурах. | |
| + | + | + Т1<Тр – Т2>Тр | Самопроизвольно может протекать реакция при высоких температурах и обратная реакция – при низких температурах. | |
| + | – | + | Прямая реакция не может идти самопроизвольно при любых температурах. |
Примечание. Величиной DG < 0 оценивается только принципиальная возможность самопроизвольного протекания, а величиной DG > 0 – невозможность самопроизвольного протекания химических реакций. Реальное протекание самопроизвольных реакций обусловлено также их кинетикой и катализом.
Стандартный изобарный потенциал образования соединений при 298 К (DG 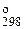 ) определяется по уравнению:
) определяется по уравнению:
DG 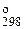 = DН
= DН 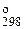 – ТDS
– ТDS 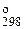 ,
,
или аналогично выражению для DН (так как изобарно-изотермический потенциал – функция состояния):
DGреак = 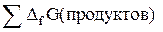 –
– 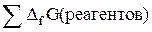 ,
,
где DG –изобарный потенциал образования соединения.
DGо298 (реак) = 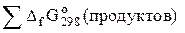 –
– 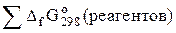 .
.
Для простых веществ в стандартном состоянии – DG 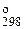 = 0
= 0
При состоянии равновесия DGреак = 0, DН = ТDS и температура начала равновесной реакции равна 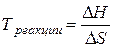
Дата добавления: 2017-11-21; просмотров: 1369;











