Внутренняя энергия. Первый закон термодинамики. Энтальпия.
Основные понятия химической термодинамики.
Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика.
Применение законов термодинамики в химии позволяет решить вопросы:
1) перехода энергии из одной формы в другую, от одной части системы к другой;
2) изучения энергетических эффектов, сопровождающих химические и физические процессы;
3) возможности и направления самопроизвольно протекающих процессов.
Система – тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособленных от нее. Внешняя среда – вещества, окружающие систему.
Различают открытую, закрытую и изолированную системы.
Система называется открытой, если через границу (реальную или условную), разделяющую систему и внешнюю среду, может происходить обмен веществом и энергией, например, жидкость и ее пар.
Система называется закрытой, если она может обмениваться энергией, например, газ в баллоне, твердые или жидкие вещества в изолированном сосуде. Изолированная система не в состоянии обмениваться с внешней средой ни веществом, ни энергией, например, запаянная ампула, полностью изолированная от внешней среды.
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения могут превращаться друг в друга. В превращениях, происходящих в ходе химических реакций, участвуют, как правило, тепловая энергия Q и механическая (или работа А). Единица измерения энергии – джоуль (Дж).
Тепловая и механическая энергия – алгебраические величины. Знаки величин тепловой энергии и механической в термодинамике рассматриваются по отношению к системе. Энергия, получаемая системой, обозначается знаком "+", отданная системой – знаком "–".
Переменные величины, определяющие состояние системы, называются параметрами состояния. Среди них в химии наиболее часто используются давление, температура, объем, состав системы. Состояние системы и происходящие в ней изменения характеризуются также с помощью функций состояния, зависящих от параметров состояния и не зависящих от пути перехода системы из одного состояния в другое. К ним относятся внутренняя энергия, энтальпия, энтропия, изобарно-изотермический потенциал.
Процессы перехода системы могут происходить при постоянстве каких-то параметров системы, так:
протекающие, при постоянном давлении – изобарные (в открытой колбе);
Большинство химических реакций протекают в открытых сосудах, т. е. при постоянном давлении, равном атмосферному.
при постоянном объеме – изохорные (в автоклаве);
при постоянной температуре – изотермические.
Внутренняя энергия. Первый закон термодинамики. Энтальпия.
В любом процессе соблюдается закон сохранения энергии. Этот закон называется первым началом термодинамики и выражается равенством
Q = DU + A
Данное равенство означает, что если к системе (веществу или совокупности веществ) подводится теплота Q, то в общем случае она расходуется на изменение внутренней энергии DU и на совершение работы А.
Под внутренней энергией системы U подразумевается общий ее запас – включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов в атомах, внутриядерную энергию и т. д., т. е. все виды энергии, кроме кинетической и потенциальной энергии системы в целом.
Определить можно лишь изменение внутренней энергии DU = U2 – U1, где U2 и U1 – внутренняя энергия системы в состоянии 2 и 1 соответственно.
Согласно закону сохранения энергии изменение внутренней энергии DU зависит только от начального и конечного состояния системы, но не зависит от способа осуществления процесса.
Под величиной А, имеют в виду, работу против всех сил, действующих на систему (т.е. рассматривается работа расширения направленная против внешнего атмосферного давления).
Для изохорного процесса (V = const) А = 0 и тепловой эффект реакции соответствует изменению внутренней энергии системы в ходе реакции QV = DU
Для изобарного процесса (Р = const). Поскольку большинство химических процессов проводят в открытых сосудах, т.е. при постоянном атмосферном давлении, но изменении объема системы DV = V2 – V1,
то А = рDV
и Qp = DU + рDV
Qp = (U2 + рV2) – (U1 + рV1)
Сумму внутренней энергии и произведения объема вещества на внешнее давление называют энтальпией (от греческого «энтальпо» – нагреваю) и обозначают буквой H:
H = U + рV, отсюда Qp = Н2 –Н1 = DН, т.е. тепловой эффект при постоянном давлении и температуре соответствует изменению энтальпии в ходе реакции.
Энтальпия DH [кДж/моль] подобно объему, давлению, температуре и внутренней энергии является функцией (характеристикой) состояния системы.
Химические процессы протекают либо с выделением (экзотермические), либо с поглощением теплоты (эндотермические).
Количество выделений (или поглощенной) теплоты называют тепловым эффектом процесса.
Химические уравнения, в которых указан тепловой эффект реакции и агрегатное состояние вещества, называют термохимическими уравнениями.
Тепловой эффект считают положительным DH > 0, для эндотермических процессов и отрицательным (DH < 0) для экзотермических. Значение DH реакции указывают после уравнения реакции. Значение DH относят к числу молей веществ, участвующих в реакции, которое указывают стехиометрическими коэффициентами (часто они бывают дробными). Кроме того, в термохимических уравнениях отмечают состояние веществ: (к) – кристаллическое, (ж) – жидкое, (г) – газообразное.
Если специально не оговорено, то DH приводится для стандартной температуры 25°С (298,15 К) и стандартного давления 101 кПа (1 атм).
Так запись H2 (г) + 1/2О2(г) ® H2O(г); DH 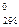 = – 285,84 кДж
= – 285,84 кДж
означает, что превращение одного моля газообразного водорода и 0,5 моль газообразного кислорода в 1 моль воды при 25°С и 101 кПа сопровождается выделением 285,84 кДж теплоты.
Энтальпия реакции в которой образуется 1 моль вещества из простых соединений в стандартных условиях называется энтальпией образования веществ, и обознается DH 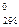 .
.
Стандартная энтальпия образования соединения – это мера его термодинамической устойчивости, прочности. Количественное выражение энергетических свойств соединения. Чем меньше стандартная энтальпия образования соединения, тем оно устойчивее.
Энтальпия образования простых веществ в стандартном состоянии принимается равной 0, т. е. DH°298(O2) = 0, DH°298(C(графит)) = 0, однако DH°298(O3) = 142,3 кДж/моль, DH°298(C(алмаз)) = 1,828 кДж/моль.
Энтальпия образования соединений может быть как отрицательной, так и положительной.
Эндотермические соединения (DH°298 > 0) неустойчивы и склонны к распаду. Получают их, как правило, не прямым синтезом из простых веществ, а косвенным путем.
В ряду однотипных соединений чем меньше стандартная энтальпия образования соединения DfH°298, тем больше его термическая устойчивость относительно разложения на простые вещества.
Дата добавления: 2017-11-21; просмотров: 2914;











