ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ В ПРИМЕНЕНИИ К ХИМИЧЕСКИМ РЕАКЦИЯМ
Как известно из раздела 2, количество теплоты, подведенной к рабочему телу, затрачивается на изменение внутренней энергии и на совершение работы против внешних сил, т.е.
dQ = dU+dL.
В данном случае считалось, что в рабочем теле не происходят химические превращения и изменяются лишь его параметры p, v,T. Протекание химических реакций связано с изменением состояния атомов в молекулах реагирующих веществ. При этом происходит изменение внутренней энергии, которое может проявляться в виде теплоты или работы.
При написании уравнения первого закона термодинамики применительно к химическим реакциям следует учесть следующие особенности.
Все уравнения, как правило, записываются не для 1 кг, а для 1 моля вещества. В величину работы реакции А наряду с работой расширения или сжатия входит также работа против электрических, световых, магнитных и других сил, проявляющихся в ходе химической реакции.
С учетом принятых особенностей уравнение первого закона термодинамики в применении к химическим реакциям будет
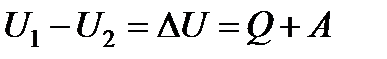 , (13.1)
, (13.1)
где ∆U - убыль внутренней энергии системы; Q - теплота реакции, А - работа реакции.
В химической термодинамике принято считать уменьшение внутренней энергии и выделившуюся при этом теплоту экзотермической реакции положительными, а увеличение внутренней энергии и поглощение теплоты (эндотермическая реакция) - отрицательными.
В соответствии с принятыми допущениями уравнение первого закона термодинамики примет вид
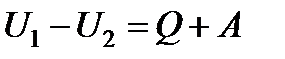 (13.2)
(13.2)
или
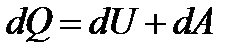 . (13.3)
. (13.3)
Работа реакции равна
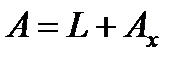 (13.3)
(13.3)
где L - работа расширения или сжатия
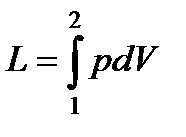 ;
;
Ах - работа против электрических, световых, магнитных и других сил.
Отсюда
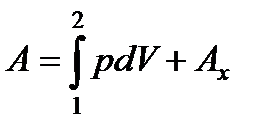 .
.
Дата добавления: 2016-06-05; просмотров: 2703;











