ПРИМЕНЕНИЕ ВТОРОГО ЗАКОНА ТЕРМОДИНАМИКИ К ХИМИЧЕСКИМ ПРОЦЕССАМ
Аналитическое выражение второго закона термодинамики для изолированной системы выше записывалось в виде
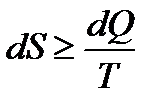 ,
,
где знаки равенства и неравенства характеризуют соответственно обратимые и необратимые процессы. Для адиабатической системы dQ = 0, и поэтому неравенство принимает вид dS ≥ 0. Отсюда следует, что энтропия изолированной системы остается постоянной при протекании в ней обратимых процессов и возрастает в случае необратимых процессов.
При протекании в системе неравновесных необратимых процессов после того, как она приходит в состояние равновесия, энтропия системы принимает максимальное значение 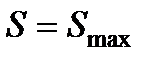 . Отсюда dS = 0 и
. Отсюда dS = 0 и 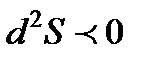 . Таким образом, энтропия является функцией, на основе которой можно находить направление процессов и условия их равновесия.
. Таким образом, энтропия является функцией, на основе которой можно находить направление процессов и условия их равновесия.
Однако для многих практических процессов оказалось более удобным вместо энтропии пользоваться другими величинами, также характеризующими необратимость процессов и равновесие системы. К числу таких величин относятся рассматриваемые ниже изохорно-изотермический F и изобарно-изотермический Z потенциалы (см. также § 5.1, 5.2).
Дата добавления: 2016-06-05; просмотров: 2604;











