ТЕПЛОТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
В химических реакциях изменение состояния системы может характеризоваться не двумя (как в технической термодинамике), а тремя или более параметрами. При этом постоянными могут оставаться два параметра. Например, при постоянном объеме и температуре (V,T)=const будем иметь изохорно-изотермическую реакцию, а при постоянном давлении и температуре - изобарно-изотермическую. Для изохорно-изотермических реакций
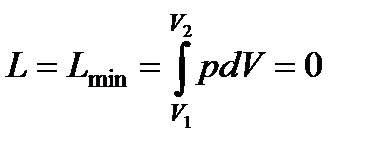 ;
;
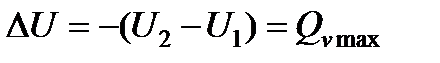 (13.6)
(13.6)
где 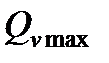 - теплота изохорно-изотермической реакции, которая равна изменению внутренней энергии.
- теплота изохорно-изотермической реакции, которая равна изменению внутренней энергии.
Для реакции при (р,T)= const dp=0 и
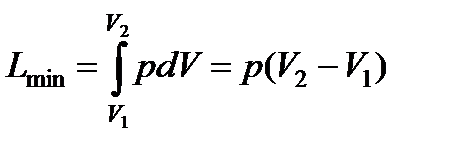 ;
;
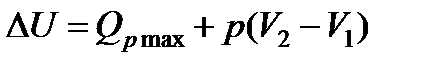 , (13,7)
, (13,7)
где Qp max - теплота реакции при постоянном давлении. Теплота реакции при p=const и при отсутствии всех видов работ, кроме работы расширения (сжатия), называется тепловым эффектом реакции.
Тепловой эффект реакции при p=const будет
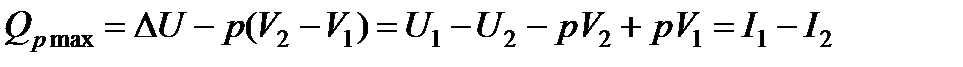 (13.8)
(13.8)
где 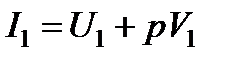 ;
; 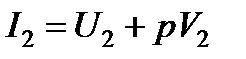 - начальная и конечная энтальпии системы
- начальная и конечная энтальпии системы 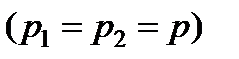 .
.
Подставляя значение 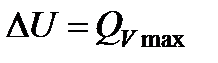 в формулу (13.8), получим
в формулу (13.8), получим
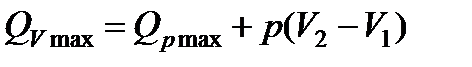 . (13.9)
. (13.9)
С учетом уравнения состояния идеального газа получим
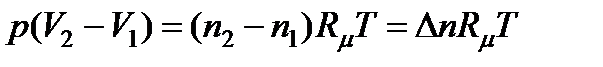 , (13.10)
, (13.10)
где ∆n - изменение числа молей газа в реакции; R μ =8,3143 Дж/(моль.К) -универсальная газовая постоянная.
Подставляя (13.10) в (13.9), находим
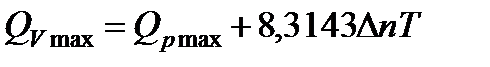 . (13.11)
. (13.11)
Последнее уравнение устанавливает зависимость между изохорно-изотермической и изобарно-изотермической теплотами реакций. Если число молей в реакции остается постоянным (∆n=0), то
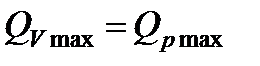 . (13.12)
. (13.12)
ЗАКОН ГЕССА
Закон Гесса устанавливает постоянство тепловых сумм, т.е. теплота реакции не зависит от ее пути, а определяется лишь начальным и конечным состоянием реагирующих веществ. Этот закон выполняется лишь для изохорно-изотермических и изобарно-изотермических процессов, так как в этих случаях 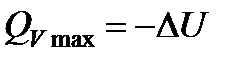 и
и 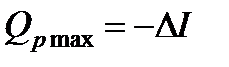 , где U и I - функции состояния и их изменения поэтому не зависят от пути процесса.
, где U и I - функции состояния и их изменения поэтому не зависят от пути процесса.
Закон Гесса позволяет вычислить теплоты большого числа реакций, если известны теплоты образования исходных веществ. К тому же этот закон позволяет вычислить теплоты таких реакций, для которых они не могут быть измерены непосредственно.
ЗАКОН КИРХГОФА
Температурная зависимость теплоты реакции определяется уравнением Кирхгофа. Для получения этой зависимости в случае изохорно-изотермической реакции продифференцируем по температуре выражение Qmax, определяемое первым законом термодинамики
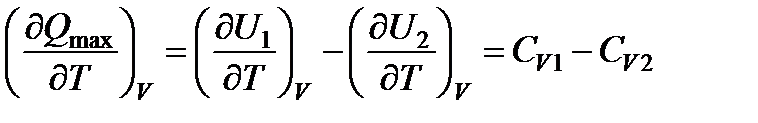 ,
,
где СV1 и CV2 - суммарные изохорные теплоемкости исходных и полученных веществ.
Аналогично для изобарно-изотермических процессов получим
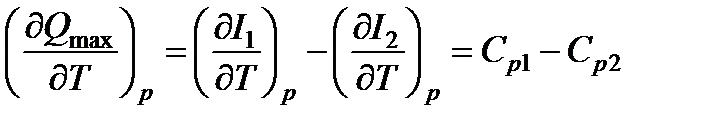 ,
,
где Ср1 и Ср2 - суммарные изобарные теплоемкости исходных и полученных веществ.
В обобщенном виде уравнение Кирхгофа имеет вид
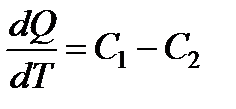 . (13.13)
. (13.13)
Суммарные теплоемкости до и после реакции находятся по формулам
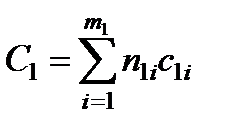 ,
, 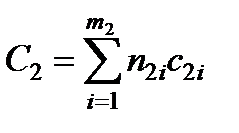 (13.14)
(13.14)
где n1, c1- числа молей и теплоемкости исходных веществ; n2, с2- числа молей и теплоемкости полученных веществ; т1, т2 - число компонентов исходных и полученных веществ.
С учетом (13.14) (13.13) примет вид
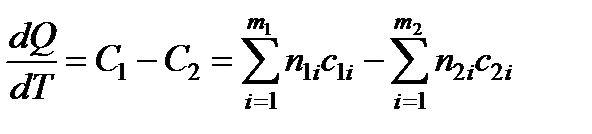 . (13.15)
. (13.15)
Последнее соотношение является математическим выражением закона Кирхгофа, где производная dQ/dT называется температурным коэффициентом теплоты реакции.
Из уравнения (13.15) можно определить теплоту реакции в случае, если будет известна ее зависимость Q = f(T)от температуры.
Дата добавления: 2016-06-05; просмотров: 2232;











