ИЗОХОРНО-ИЗОТЕРМИЧЕСКИЙ И ИЗОБАРНО-ИЗОТЕРМИЧЕСКИЙ ПОТЕНЦИАЛЫ
В химической термодинамике считается, что убыль внутренней энергии положительна, а теплота, сообщенная системе, отрицательна. Уравнения первого и второго законов термодинамики с учетом принятых знаков будут иметь вид
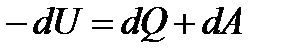 ;
;
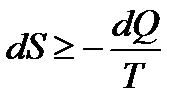 .
.
Объединяя эти уравнения, получим
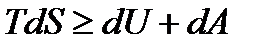 . (13.16)
. (13.16)
Если учитывать только работу изменения объема, то 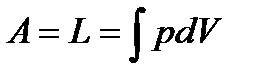 . Тогда
. Тогда
соотношение (13.16) примет вид
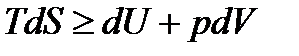 . (13.17)
. (13.17)
Или в записи через энтальпию
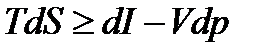 . (13.18)
. (13.18)
Преобразуем уравнение (13.17) следующим образом
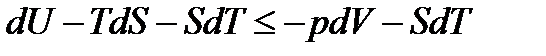 ;
;
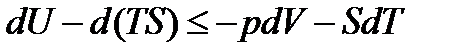 ;
;
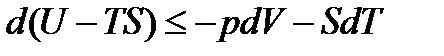 , (13.19)
, (13.19)
где 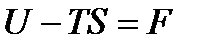 является некоторой функцией состояния, которая была названа выше (см. §5.1) изохорно-изотермическим потенциалом.
является некоторой функцией состояния, которая была названа выше (см. §5.1) изохорно-изотермическим потенциалом.
Соотношение (13.19) перепишем в виде
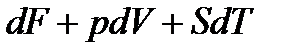 . (13.20)
. (13.20)
В изохорно-изотермических процессах V = const, T = const. Следовательно, 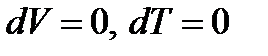 . Тогда (13.20) примет вид
. Тогда (13.20) примет вид
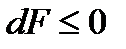 .
.
Отсюда следует, что в изолированных системах, находящихся при постоянной температуре и объеме, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением изохорно-изотермического потенциала F. Причем минимум F = Fmin наблюдается в состоянии равновесия. При этом
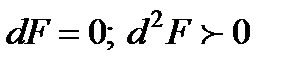 .
.
Если рассматривать функцию F как функцию независимых параметров Т и V, то ее полный дифференциал будет
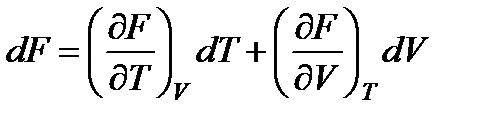 .
.
Сопоставляя это соотношение с соотношением (13.20), получим
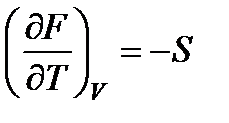 ;
; 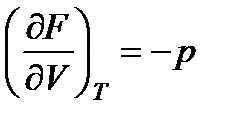 . (13.21)
. (13.21)
Из этих равенств следует, что изменение F по температуре при постоянном объеме определяется величиной энтропии, а изменение F по объему при постоянной температуре - величиной давления. Таким образом, F является характеристической функцией, так как ее частные производные позволяют определить термодинамические свойства системы (см. § 5.1).
Подставляя величину энтропии из (13.21) в формулу 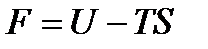 , получим
, получим
аналитическое выражение уравнения, связывающего изохорно-изотермический потенциал с внутренней энергией
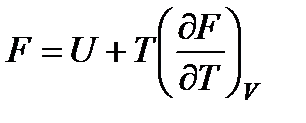 . (13.22)
. (13.22)
Если к обеим частям уравнения (13.17) прибавить соотношение 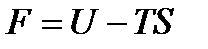 , то после некоторых преобразований получим
, то после некоторых преобразований получим
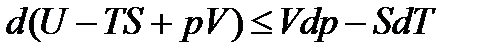 . (13.23)
. (13.23)
Обозначим
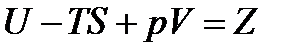 . (13.24)
. (13.24)
Отсюда Z = F+pV или 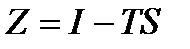 , так как I = U+pV.
, так как I = U+pV.
Величина Z из уравнения (13.24) выше (см. § 5.1) была названа изобарно-изотермическим потенциалом и является некоторой функцией состояния. Из (13.23) следует
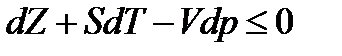 .
.
Так как в изобарно-изотермических процессах dT=0, dp=0, то
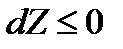 .
.
Отсюда следует, что в изобарно-изотермических процессах в изолированной системе самопроизвольно могут протекать только такие процессы, которые сопровождаются уменьшением Z и в пределе (в состоянии равновесия) достигается некоторое минимальное значение этой величины, т.е.
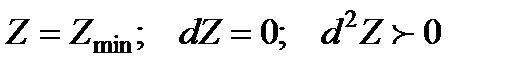 .
.
Как следует из (13.24), функция Z является характеристической функцией при независимых параметрах р и T. Ее полный дифференциал будет
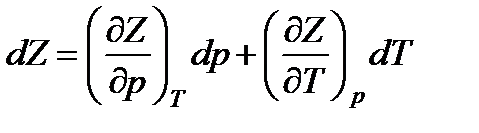 .
.
Сравнивая это уравнение с равенством (13.24), получим
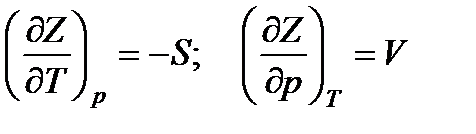 .
.
Подставляя найденное значение энтропии в формулу  , получим уравнение, связывающее изобарно-изотермический потенциал с энтальпией
, получим уравнение, связывающее изобарно-изотермический потенциал с энтальпией
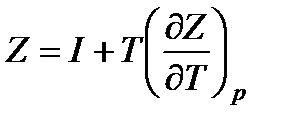 . (13.25)
. (13.25)
Таким образом, в некоторых частных случаях в качестве критерия равновесия системы можно использовать изохорно- и изобарно-изотермический потенциалы. Условием равновесия процессов при (V,t)= const и (p,T)= const является минимум этих потенциалов. Функции F и Z характеризуют ту часть внутренней энергии или энтальпии, которая может переходить в полезную работу.
Дата добавления: 2016-06-05; просмотров: 4854;











