Гальванический элемент Даниэля-Якоби
Гальванический элемент Даниэля-Якоби (рис. 9.2) состоит из медного и цинкового электродов, погруженных соответственно в растворы CuSО4 и ZnSО4.
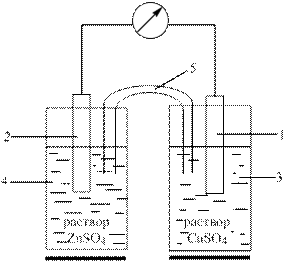
Рис. 9.2. Схема гальванического элемента Даниеля-Якоби:
1 – медный электрод, 2 – цинковый электрод, 3 – раствор сульфата меди,
4 – раствор сульфата цинка, 5 – солевой мостик
При разомкнутой цепи на обоих электродах устанавливаются равновесия:
на цинковом электроде: Zn0 –2ē D Zn2+,
на медном электроде: Cu0− 2ē D Cu2+.
При замыкании электродов металлическим проводником электроны оттуда, где их больше будут переходить туда, где их меньше, т.е. от цинка к меди, в цепи появится электрический ток. Равновесие на электродах нарушится. На цинке будет идти анодная реакция растворения цинка, а на меди – катодный процесс восстановления меди:
Zn0 –2ē → Zn2+,
Cu2+ +2ē → Cu0.
Условно гальванический элемент записывают, разделяя металл и раствор одной вертикальной чертой, а растворы двумя:
| (–) Zn | ZnSO4 || CuSO4 | Cu (+) анод р-р р-р катод |
При работе гальванического элемента у цинкового электрода происходит увеличение концентрации Zn2+,а у медного уменьшение Cu2+. Соотношение катион-анион в растворах нарушается. Растворы CuSO4 и ZnSO4 соединены между собой солевым мостиком - стеклянной трубкой, с насыщенным раствором KCl. Так как раствор должен оставаться электронейтральным, то через солевой мостик происходит переход анионов из раствора, где их больше, в раствор, где их меньше.
Вследствие химических процессов в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри гальванического элемента, т.е. электрический ток, поэтому суммарная химическая реакция, протекающая в гальваническом элементе, называется образующей ток. Токообразующей реакцией в элементе Даниэля-Якоби является реакция:
Zn0 + CuSO4 → ZnSO4 + Cu0.
Максимальная работа, которую может совершить гальванический элемент, благодаря протеканию самопроизвольной окислительно-восстановительной реакции, определяется уменьшением энергии Гиббса:
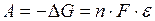
| (9.1) |
где ε – электродвижущая сила (ЭДС) элемента, n – число электронов участвующих в электрохимической реакции, F- число Фарадея.
Так как в элементе протекает самопроизвольный процесс (ΔG < 0), то ЭДС является положительной величиной.
Электродвижущей силой элемента называется разность электродных потенциалов катода и анода:
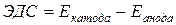
| (9.2) |
Прохождение электрического тока через гальванический элемент нарушает равновесие на электродах. Потенциал таких электродов отличается от равновесного. ЭДС элемента следует измерять, когда электрический ток, проходящий через гальванический элемент бесконечно мал. С этой целью используют компенсационный метод измерения. ЭДС гальванического элемента компенсируют внешней, противоположно направленной разностью потенциалов, которая отличается от ЭДС элемента на бесконечно малую величину. Или измеряют ЭДС высокоомным вольтметром, позволяющим сохранить обратимость гальванического элемента.
Дата добавления: 2017-11-21; просмотров: 4075;











