Химические источники тока
В предыдущем разделе был рассмотрен гальванический элемент (первичный элемент) – источник тока одноразового действия, который после расходования реагентов, например, растворения цинкового электрода, становится неработоспособным.
Вторичные элементы - аккумуляторы можно использовать многократно, так как при пропускании постоянного тока от внешнего источника происходит регенерация израсходованных реагентов (зарядка аккумулятора). Примером вторичного источника тока является свинцово-кислотный аккумулятор. Он состоит из положительных и отрицательных электродов и электролита. Электродами служат свинцовые решетки заполненные, пероксидом свинца (PbO2) - положительные электроды, или губчатым свинцом (Pb) - отрицательные электроды Электроды погружены в электролит, состоящий из 30%-ной серной кислоты.
При разрядке аккумулятора химическая энергия превращается в электрическую, при этом свинцовый электрод является анодом, а электрод из PbO2 – катодом. Электродные процессы выражаются уравнениями:
Катод PbO2 (+): PbO2 + 4H+ + 2SO42– +2ē → PbSO4 + 2H2O,
Анод Pb (–): Pb + SO42– –2ē → PbSO4.
При зарядке аккумулятора на катоде, который соединен с отрицательным полюсом источника постоянного тока, ионы Pb2+ (из PbSO4) присоединяют по два электрона, восстанавливаясь до металлического свинца, а на аноде – отдают по два электрона, окисляясь до PbO2. Таким образом, при зарядке аккумулятора электрическая энергия превращается в химическую. Протекающие при этом химические процессы выражаются ионными уравнениями:
Катод (–): PbSO4 +2ē → Pb0 + SO42–,
Анод (+): PbSO4 + 2H2O –1ē → PbO2 + SO42– + 4H+.
Суммируя эти одновременно протекающие процессы, получим уравнение химической реакции, протекающей при зарядке аккумулятора:
2PbSO4 + 2H2O → Pb + PbO2 + 4H+ + 2SO42–.
Схема гальванического элемента: (–) Pb | H2SO4 || PbO2 (+).
ЭДС = 1,68 – (–0,36) = +2,04 В.
Топливные элементы – химические источники тока, способные непрерывно работать в течение длительного времени, пока к электродам подводятся реагенты.
В топливных элементах токообразующей реакцией является окисление водорода:
А(–): H2 –2ē → 2H+,
K(+): О2 + 4Н+ +4ē → 2H2O.
Топливные элементы различаются устройством электродов, и составом электролита. Так твердотопливный элемент имеет пористые катод и анод, активированные платиновыми металлами, и электролит - керамический материал, проводящий ионы O2–, обычно – ZrO2, легированный Y2O3.
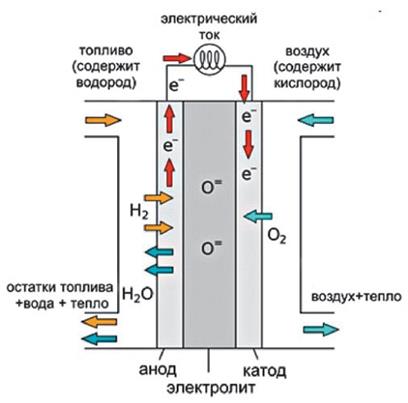
Рис. 9.3.Схема твердотопливного элемента
Роль электролита в различных керамических матрицах могут выполнять карбонаты щелочных металлов, фосфорная кислота, гидроксид калия. В топливном элементе с протонпроводящей мембраной роль электролита играет полимерная, проводящая ионы водорода мембрана.
Широта применения топливных элементов определяется их КПД (от 40 до 80%), небольшими габаритами, высокой экономичностью. Они используются как небольшие стационарные источники тока, применяются на транспорте, в космических аппаратах, в больницах и аэропортах, как резервные.
Коррозия металлов
Разрушение металлов и сплавов под действием факторов окружающей среды называется коррозией. В свободном состоянии большинство металлов являются термодинамически неустойчивыми, хотя металл служит примером прочного материала.
Большинство металлов, кроме благородных, в природе встречаются в виде химических соединений, в которых они находятся в ионном состоянии. Восстановление металлов из их природных соединений связано с затратой энергии. В процессе коррозии металл переходит в окисленное (ионное) состояние, при этом теряет присущие ему металлические свойства. Разрушение металлов является самопроизвольным процессом и протекает с уменьшением энергии Гиббса. Коррозия наносит огромный экономический ущерб. Поэтому борьба с коррозией является актуальной задачей науки. Для ее решения изучаются причины возникновения коррозии, механизмы ее протекания, и на этой основе разрабатываются эффективные методы защиты металлов и конструкций от коррозии.
В зависимости от механизма коррозионного процесса различают химическую и электрохимическую коррозию.
Дата добавления: 2017-11-21; просмотров: 1590;











