Измерение электродных потенциалов. Электроды сравнения
Измерить потенциал одного электрода невозможно, т.к. это означало бы измерить разность потенциалов электрода и раствора. Если, исходя из уравнения 9.2, потенциал одного из электродов принять равным 0, то потенциал другого окажется равным ЭДС элемента. В качестве стандартного электрода, относительно которого сравнивают потенциалы других электродов, служит водородный электрод. Международным соглашением потенциал водородного электрода при стандартных условиях (а(Н+) = 1, р(Н2) = 1 атм.) принят равным нулю.
Водородный электрод содержит платиновый электрод, покрытый для увеличения поверхности платиновой чернью и погруженный в одномоляльный раствор H2SO4, через который пропускается очищенный газообразный водород под давлением равным одной атмосфере. Платина не принимает участия в электродных реакциях, а играет роль проводника и катализатора распада молекул водорода на атомы.
На поверхности платины между адсорбированным водородом и ионами водорода в растворе устанавливается равновесие:
H2 –2ē D 2H+.
Для измерения потенциала электрода, составляют гальванический элемент, в котором одним электродом является измеряемый, а другим – водородный электрод. Например, потенциал медного электрода равен ЭДС гальванического элемента, в котором водородный электрод является анодом. Если в гальваническом элементе водородный электрод является катодом, то потенциал второго электрода будет иметь отрицательную величину по отношению к стандартному водородному электроду:
| (–) Pt,H2 | 2H+ || Cu2+ | Cu (+) E° = 0 Eк | ||
| (−) Zn│Zn2+║2H+│H2,Pt (+). Eа E° = 0 |
Стандартный электродный потенциал (Е°) – потенциал металла при единичной концентрации его ионов, измеренный относительно водородного электрода.
Все металлы по величине стандартных потенциалов, характеризующих их восстановительную способность, располагают в определенной последовательности, называемой рядом напряжений.
Чем меньше алгебраическая величина электродного потенциала металла, тем больше восстановительная активность его атомов (способность отдавать электроны).
Однако водородный электрод обладает рядом недостатков: к изменению давления водорода, к ядам, отравляющим платиновый электрод.
Для практических целей измерения потенциалов используются более простые по конструкции электроды сравнения, например, хлорсеребряный, потенциал которого хорошо воспроизводится. В насыщенном растворе KCl он равен +0,22 В. Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую трудно растворимым хлоридом серебра, помещенную в стеклянную трубку с оттянутым кончиком, заполненную насыщенным раствором хлорида калия: (Cl–/AgCl,Ag) .
Через оттянутый кончик, в который вставлен асбестовый фитилек, выполняющий роль солевого мостика, электрод соединяется с полуэлементом, потенциал которого измеряется.
Активность катионов серебра определяется произведением растворимости труднорастворимого AgCl, и зависит от концентрации ионов хлора в электролите, которая в насыщенном растворе KCl при данной температуре является величиной постоянной:
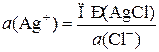 .
.
От постоянства активности ионов зависит постоянство значения электродного потенциала, связь этих показателей описывается уравнением Нернста.
Уравнение Нернста
Величина электродного потенциала зависит от природы металла, активности электролита, и температуры. Эта зависимость описывается уравнением Нернста:
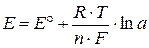
| (9.3) |
где Е° – стандартный электродный потенциал, В; R – универсальная газовая постоянная, 8,31 Дж/град·моль; Т – абсолютная температура, К; n – число электронов, участвующих в электрохимической реакции; F – постоянная Фарадея, 96500 Кл/моль; a – активная концентрация ионов металла в растворе, моль/л.
Если в уравнении (9.3) подставить числовые значения R, F, стандартное значение Т (298 K) и перевести натуральный логарифм в десятичный, получим:
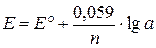
| (9.4) |
При низкой концентрации ионов электролита в растворе вместо активности можно использовать аналитическое значение концентрации ионов:
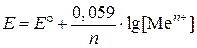 . .
| (9.5) |
Зависимость потенциала водородного электрода от концентрации ионов Н+ в растворе описывается уравнением:
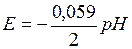
| (9.6) |
При повышении рН раствора потенциал водородного электрода смещается от 0 к отрицательным значениям. В нейтральной среде (рН = 7) потенциал водородного электрода равен –0,41 В, в щелочной (рН = 14) соответственно –0,82 В.
Дата добавления: 2017-11-21; просмотров: 4003;











