Метод электронного баланса
Необходимо помнить основные правила составления уравнений методом электронного баланса:
а) сумма электронов, отдаваемых всеми восстановителями равна сумме электронов, принимаемых всеми окислителями;
б) число одноименных атомов в левой и правой частях уравнения должно быть одинаково.
Составление уравнений окислительно-восстановительных реакций легче провести в несколько стадий: 1) установление формул исходных веществ и продуктов реакции; 2) определение степени окисления элементов в исходных веществах и продуктах реакции; 3) определение числа электронов, отдаваемых восстановителем и принимаемых окислителем, и коэффициентов при восстановителях и окислителях; 4) определение коэффициентов при всех исходных веществах и продуктах реакции, исходя из баланса атомов в левой и правой частях уравнения.
8Na0 + 5H2+S+6O4–2 = 4Na2+S+6O4–2 + H2+S–2 + 4H2+O–2
| Восстановитель | 2Na0 –2ē → 2Na+ | |
| Окислитель | S+6 +8ē → S–2 |
Обратите внимание на то, что при взаимодействии металлов с кислотами-окислителями (H2SO4(к), HNO3) последние не только восстанавливаются, но и расходуются на образование соли (без изменения степени окисления), поэтому перед формулой кислоты-окислителя ставится суммарный коэффициент. В нашем примере один атом S+6 восстановился до S–2, и еще четыре атома S+6 не изменили степени окисления, поэтому перед формулой H2SO4 коэффициент 5.
В тех случаях, когда в ОВР участвуют два восстановителя, входящих в состав одного вещества, и один окислитель или наоборот (несколько окислителей и один восстановитель), то суммируют все «отданные» или все «принятые» электроны, и лишь после этого находят дополнительные множители.
|
| В-ли | 2As+3 – 4ē ® 2As+5 3S–2 − 18ē ® 3S+4 | –22 | Реакция межмолекулярного окисления-восстановления | |
| Ок-ль | N+5 + 3ē → N+2 |
Ионно-электронный метод
Этот метод применяют для составления уравнений окислительно-восстановительных реакций протекающих в растворах электролитов. В его основе лежит составление ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. При составлении ионных уравнений следует пользоваться правилами: формулы сильных электролитов записывать в виде ионов, а слабых электролитов, газов, осадков, – в виде молекул. В краткие уравнения не следует вносить ионы, не изменяющиеся в процессе реакции. Составление уравнений методом полуреакций предполагает учет роли частиц среды, в которой протекает реакция (Н+, ОН–, Н2О). В приведенной ниже таблице 8.1 показано, какие процессы обычно имеют место в разных средах.
Таблица 8.1
Влияние среды на протекание ОВР
| Среда | В левой части полуреакции окисления или восстановления | |
| избыток кислорода | недостаток кислорода | |
| Кислая | На каждый избыточный O2– добавить 2Н+ | На каждый недостающий O2– добавить одну Н2О |
| Нейтральная | На каждый избыточный O2– добавить одну Н2О | |
| Щелочная | На каждый недостающий O2– добавить 2ОН– |
K2Cr2O7 + Na2SO3 + H2SO4 → Cr2+3(SO4)3 + Na2SO4 + H2O + K2SO4
Напишем схему реакции в кратком ионном виде:
(Cr2+6O7)2– + SO32– + H2O → Cr23+ + SO42– + 2H+
Составим уравнения полуреакций с учетом влияния кислой среды (см. таблицу 8.1), найдем коэффициенты:
| Cr2O72–+ 14H+ + 6ē → Cr+3 + 7H2O | |||
| SO32– + H2O – 2ē → SO42– + 2H+ |
Сложим почленно части уравнений полуреакций с учетом найденных коэффициентов, сократим одноименные слогаемые:
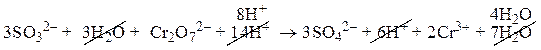
Допишим к ионнам краткого уравнения имеющиеся в реакции ионы с противоположным знаком:
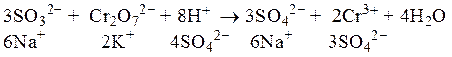
В результате получим молекулярное уравнение окислительно-восстановительной реакции.
K2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 3Na2SO4 + 4H2O + K2SO4
Направление протекания окислительно-восстановительной реакции зависит от того, в какой среде она идет (кислой, нейтральной или щелочной). Так реакции восстановления перманганата марганца в кислой среде протекают с образованием соли марганца (II), в нейтральной среде - оксида марганца (IV), а в щелочной – соли марганцовистой кислоты (H2MnO4) – манганата:
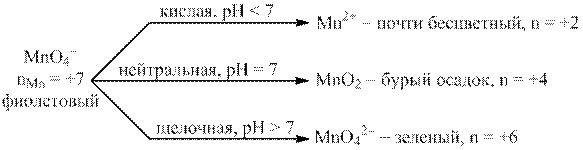
Если к подкисленному серной кислотой раствору KMnO4, имеющему фиолетовую окраску, добавить восстановитель, например, K2SO3, то раствор обесцветится, т.к. образующиеся ионы марганца (II) очень слабо окрашены. Реакция выражается уравнением:
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O,
в ионной форме:
2MnO4– + 5SO32– + 6H+ = 2Mn2+ + 5SO42– + 3H2O.
В нейтральной среде реакция между этими веществами протекает с образованием бурого осадка оксида марганца (IV) по уравнению:
2KMnO4 + 3K2SO3 + H2O = 2MnO2↓ + 3K2SO4 + 2KOH,
2MnO4– + 3SO32– + H2O = 2MnO2↓ + 3SO42– + 2OH–.
В концентрированном растворе щелочи образуются ионы манганата, которые окрашивают раствор в зеленый цвет:
2MnO4– + SO32– + 2OH– = 2MnO42– + SO42– + H2O.
8.4. Типы окислительно−восстановительных реакций
Рассмотренные примеры ОВР относятся к реакциям межмолекулярного окисления−восстановления. В этих реакциях имеется вещество окислитель и вещество − восстановитель.
В некоторых случаях один и тот же атом, молекула или ион играет роль и окислителя и восстановителя. Это процесс самоокисления-самовосстановления или диспропорционирования.
2Cl+4O2–2 + H2+O–2 = H+Cl+5O3–2 + H+Cl+3O2–2
| Восстановитель | Сl+4 – 1ē → Cl+5 | реакция диспропорционирования | |
| Окислитель | Сl+4 + 1ē → Cl+3 | (самоокисление-самовосстановление) |
В данной реакции хлор претерпевает и окисление и восстановление.
В составе некоторых молекул могут находиться атомы-восстановители и атомы-окислители. Такие молекулы могут претерпевать внутримолекулярное окисление-восстановление.
N–3H4+N+5O3–2  N2+O–2 + H2+O–2
N2+O–2 + H2+O–2
| Восстановитель | N–3 –4ē → N+1 | Реакция внутримолекулярного окисления-восстановления | |
| Окислитель | N+5 +4ē → N+ |
Здесь ион NH4+ окисляется, а ион NO3– восстанавливается.
В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны. Например, в реакции между цинком и солью меди восстановителем является цинк, он отдает свои электроны положительно заряженным ионам меди, которые являются окислителем. Медь осаждается на поверхности цинка, а ионы цинка переходят в раствор.
Zn + CuSO4 = Cu + ZnSO4
Zn0 –2ē = Zn2+ (окисление)
Cu2+ +2ē = Cu0 (восстановление)
Дата добавления: 2017-11-21; просмотров: 2467;











