Реакции обмена в растворах электролитов
Свойства водных растворов электролитов определяются свойствами тех ионов, на которые они диссоциируют. Так кислоты можно определить, как электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Наличие этих ионов определяет общие химические свойства кислот. Основания– электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-анионы.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. И каждая ступень имеет свое значение константы диссоциации. Величина константы диссоциации по первой ступени самая большая. Т.к. оторвать ион от незаряженной частицы легче, чем от заряженной.
| H2S D H+ + HS– | 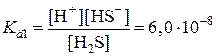
|
| HS– D H+ + S2– | 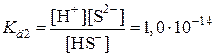
|
Mg(OH)2 D MgOH+ + OH–,
MgOH+ D Mg2+ + OH–.
Реакции в растворах электролитов сводятся к взаимодействию ионов растворенных веществ. Эти реакции идут только в том случае, если в результате образуются молекулы трудно растворимого, газообразного или малодиссоциированного вещества. Если в реакцию вступают слабые электролиты, летучие или малорастворимые вещества, то реакция происходит в тех случаях, когда образующиеся вещества будут менее диссоциированными, более летучими, менее растворимыми.
7.8.1. В реакциях, идущих с выделением газов, образуются водородные соединения неметаллов (такие как сероводород, аммиак, галогеноводороды), летучие оксиды (SO2, CO2).
ZnS + 2HCl = ZnCl2 + H2S↑,
ZnS + 2H+ = Zn2+ + H2S↑.
7.8.2. В реакциях, идущих с образованием трудно растворимых веществ, последние выводятся из сферы реакции в виде осадка.
CaCl2 + K2CO3 = CaCO3↓ + 2KNO2,
Ca2+ + CO32– = CaCO3↓.
Осадок трудно растворимого вещества находится в состоянии динамического равновесия с насыщенным раствором. Вещества с ионной кристаллической решеткой переходят в раствор в виде ионов. Процесс растворения – гетерогенный, происходит на поверхности осадка, поэтому константа равновесия будет определяться только произведением концентрации ионов в растворе.
Произведение концентраций ионов трудно растворимого электролита, содержащегося в его насыщенном растворе при данной температуре, есть величина постоянная. Эту величину называют произведением растворимости электролита, обозначают буквами ПР. Значения ПР для малорастворимых веществ приведены в таблице приложения 7.
CaCO3 D Ca2+ + CO32–
ПР = [Ca2+] [CO32–] = 4,8 × 10–9
7.8.3. В качестве слабых электролитов в реакциях обмена могут образовываться:
1) слабые кислоты (уксусная, угольная, кремниевая и др.):
CH3COONa + HCl = CH3COOH + NaCl,
CH3COO– + H+ = CH3COOH.
2) нерастворимые основания:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4,
Cu2+ + 2OH– = Cu(OH)2↓.
3) комплексные ионы (например, ион-гидроксокомплекс в реакции амфотерных гидроксидов со щелочами):
Zn(OH)2 + 2KOH = K2[Zn(OH)4],
Zn(OH)2 +2OH– = [Zn(OH)4]2–.
4) вода в реакции нейтрализации:
KOH + HNO3 = KNO3 + H2O,
OH– + H+ = H2O.
7.8.4. Вода как слабый электролит. Водородный показатель
Вода является очень слабым электролитом. Процесс диссоциации ее можно описать константой равновесия:
Н2О D Н+ + ОН–,
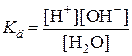 .
.
Но так как концентрация воды в процессе диссоциации практически не меняется, ее можно включить в константу, тогда получается следующее выражение Kв, которое называется ионным произведением воды и равно 10–14.
| Kв = [H+][OH–] = 10–14. | (7.19) |
Таким образом, в водных растворах концентрации ионов водорода и гидроксил-ионов связаны между собой, и зная величину концентрации одного иона, можно легко определить концентрацию второго иона.
Водородный показатель. Вода является амфотерным веществом, так как при диссоциации распадается на ионы водорода и гидроксила. В присутствии других веществ соотношение ионов может меняться. Для характеристики кислотности среды датским ученым Сёренсеном в 1909г. введен водородный показатель или рН – это отрицательный логарифм концентрации ионов водорода в растворе.
| pН = –lg[H+] | (7.20) |
Зная величину рН, можно вычислить концентрацию ионов водорода в растворе:
| [H+] = 10–pН | (7.21) |
В чистой воде концентрация ионов водорода и гидроксид-ионов равны 10–7 моль/л. Логарифм этой величины, взятой с обратным знаком равен 7. При рН = 7 – среда нейтральная. В кислой среде концентрация ионов водорода будет больше, соответственно рН будет меньше 7 (при pH < 7 – среда кислая). В щелочной – больше 7 (рН > 7 среда щелочная).
Приближенно величину рН можно определить, используя кислотно-основные индикаторы. Кислотно-основными индикаторами или просто индикаторами, называют вещества, меняющие свою окраску в определенной области значений рН раствора. Индикаторами могут быть слабые органические кислоты HInd и основания IndOH, молекулы и ионы которых имеют разную окраску.
Существует так называемый универсальный индикатор – это смесь различных индикаторов. Цвет его изменяется от красной (рН < 3,4) окраски [через оранжевую (рН 3,4–4,7), желтую (рН 4,7–6,2), зеленую (рН 6,2–7,2), голубую (7,2–8,5)] до фиолетовой (рН > 8,5).
Гораздо точнее можно измерить значения рН специальными приборами – рН-метроми (рис. 7.4). При помощи этих приборов можно определить рН растворов в диапазоне от 0 до 14 с точностью до 0,01 единицы рН.

Рис. 7.4. рН-метр-ионометр ЭКСПЕРТ-001:
1 – внешний вид измерительного преобразователя, 2 – цифровой ЖК дисплей, 3 – клавиатура, 4 – температурный датчик, 5 – электрод стеклянный комбинированный (для измерения рН), 6 – пробка для отверстия
Буферные растворы
Растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания, называются буферными. Они обычно содержат слабую кислоту и ее соль с сильным основанием, например, СН3СООН + СН3СООK или слабое основание и его соль с сильной кислотой, например, NH4OH + NH4Cl.
При добавлении в первую систему (ацетатный буфер) раствора сильной кислоты ионы водорода связываются ацетат-ионами соли в слабую уксусную кислоту, и поэтому не вызывают подкисления раствора. При добавлении в ацетатный буфер раствора щелочи гидроксид-ионы связывается в воду (слабый электролит) при взаимодействии с уксусной кислотой.
Образование слабых электролитов при добавлении в буферный раствор кислоты или основания и обусловливает устойчивость рН в буферных растворах.
Кровь и тканевая жидкость живых организмов обладают буферными свойствами благодаря электролитам в их составе. Это имеет огромное значение для поддержания постоянства внутренней среды – гомеостаза. Почвенные растворы также обладают буферностью, что обусловлено содержанием в них гидрокарбонатов, фосфатов и др.
Гидролиз солей
Гидролиз - обменное разложение некоторых солей водой, в результате которого образуются слабые электролиты. При этом в растворе появляется некоторое избыточное количество ионов Н+ или ОН–, которые сообщают раствору кислотные или щелочные свойства. Таким образом, процесс гидролиза солей во многом обратен процессу нейтрализации.
Гидролизу не подвергаются соли, образованные сильными кислотой и основанием, например, KCl.
Гидролиз соли, образованной слабой кислотой и сильным основанием, например, CH3COONa в ионной форме можно представить уравнением:
CH3COO– +H2O D CH3OOH + OH–.
В результате реакции образуется слабый электролит – уксусная кислота и ионы ОН–, которые подщелачивают среду. В соответствии с принципом Ле-Шателье равновесие такой реакции можно смещать, подавляя гидролиз или увеличивая его степень. Повышением температуры, равновесие смещается вправо, поскольку гидролиз – реакция эндотермическая. Увеличением концентрации кислоты равновесие смещается влево, а разбавлением (добавлением воды) – вправо.
Как любую обратимую реакцию, гидролиз соли можно характеризовать константой равновесия:
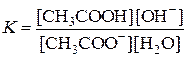
|
Концентрация воды в растворе практически постоянна, поэтому она входит в константу, в результате получаем выражение константы равновесия, которая называется константой гидролиза (Кг):
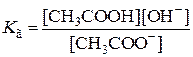
| (7.22) |
Константа гидролиза характеризует способность соли подвергаться гидролизу, чем константа больше, тем в большей степени протекает гидролиз. Константа гидролиза связана с константой диссоциации слабой кислоты (Kкисл) зависимостью:
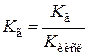
| (7.23) |
Из уравнения следует, что чем слабее кислота, т.е. чем меньше ее константа диссоциации, тем больше константа гидролиза.
Ели слабая кислота является многоосновной, то в результате гидролиза образуются кислые ионы (HSO3–, HPO42–, H2PO4–, HCO3–), которые являются более слабыми электролитами, чем сама кислота:
CO32– + HOH D HCO3– + OH–.
Гидролиз солей, образованных слабым основанием и сильной кислотой ведет к образованию слабого основания и ионов водорода:
NH4+ +H2O D NH4OH + H+.
Если основание многокислотное, то в результате реакции образуются ионы слабого основания (CuOH+, FeOH2+, Fe(OH)2+, ZnOH+), которые являются более слабыми электролитами, чем само основание, и ионы водорода, подкисляющие раствор:
Cu2+ + HOH D CuOH+ + H+.
Константу гидролиза такой соли можно рассчитать по уранению аналогичному уравнению 7.25, используя вместо константы диссоциации кислоты (Kкисл) константу диссоциации слабого основания (Kоснов).
При гидролизе солей, образованных слабым основанием и слабой кислотой образуются ионы водорода и гидроксид-ионы. Концентрация этих ионов зависит от констант диссоциации соответствующей кислоты и основания. Соотношение концентраций этих ионов определяет, будет ли среда кислой или щелочной.
NH4F +H2O D NH4OH + HF
NH4+ + H2O D NH4OH + H+
F– + H2O D HF + OH–.
В ряде случаев соли, образованные слабыми кислотами и основаниями, не существуют в растворах, поскольку разлагаются водой в результате полного гидролиза.
Дата добавления: 2017-11-21; просмотров: 2403;











