Понижение температуры замерзания и повышение температуры кипения разбавленных молекулярных растворов
Понижение давления пара над раствором по сравнению с чистым растворителем вызывает понижение температуры замерзания и повышение температуры кипения растворов. Жидкость замерзает при той температуре, когда давление пара над ней равно давлению пара над ее льдом, а кипит при равенстве давления пара над ней атмосферному давлению. Поскольку давление пара над раствором, ниже, чем над растворителем то, как видно на графиках 7.1 и 7.2 становится равным давлению пара надо льдом при более низкой температуре, а значения атмосферного оно достигает при более высокой температуре.
Изменение температуры замерзания (DТз) – разность температур замерзания растворителя (Т0) и раствора (Тз р-ра):
| DТз = Т0 – Тз р-ра. | (7.8) |
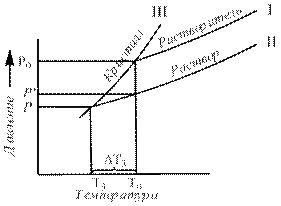
Рис. 7.1.Связь понижения давления пара с понижением температуры замерзания.
DТз (понижение температуры замерзания) увеличивается с концентрацией:
| DТз = ЕзСm, | (7.9) |
где Ез –моляльное понижение температуры замерзания (криоскопическая постоянная растворителя) – понижение температуры замерзания при растворении 1 моль неэлектролита в 1000 г растворителя; Сm – моляльная концентрация.
Ез - справочная величина зависит только от природы растворителя: вода – 1,86; бензол – 5,1; фенол – 7,3; анилин – 5,9 град/моль.
Зависимость повышения температуры кипения от концентрации описывается следующим образом:
| DТк = Тр-р – Т0, | (7.10) | |
| DТк = ЕкСm, | (7.11) |
где DТк – повышение температуры кипения; Сm – моляльная концентрация; ЕЭ – моляльное повышение температуры кипения растворителя (эбуллиоскопическая постоянная) – повышение температуры кипения для раствора, содержащего 1 моль растворенного неэлектролита в 1000 г растворителя. ЕЭ зависит только от природы растворителя: вода – 0,5; бензол – 1,2; этиловый спирт – 2,1 град/моль растворенного вещества. И не зависит от природы растворенного неэлектролита и его концентрации.
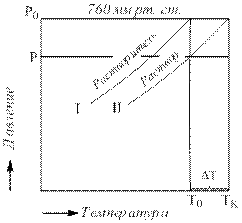
Рис. 7.2. Связь понижения давления пара с повышением температуры кипения.
Используя уравнения (7.4), (7.9) и (7.11), можно по изменению температуры замерзания раствора определить молярную массу вещества. Для этого экспериментально определяют повышение температуры кипения или понижение температуры замерзания раствора. Если известна масса растворенного вещества m2 и растворителя m1 то молярную массу растворенного вещества М определяют по уравнению:
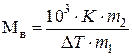 , ,
| (7.12) |
где K = Еэ, либо K = Ек.
Осмос
Если раствор и чистый растворитель разделены мембраной, проницаемой для молекул растворителя и непроницаемую для молекул растворенного вещества (полупроницаемую), то молекулы растворителя через полупроницаемую мембрану будут переходить в раствор, что приведет к разбавлению раствора. Такое явление получило название осмос – односторонняя диффузия растворителя из менее концентрированного в более концентрированный раствор через полупроницаемую мембрану.
Это происходит из-за диффузии молекул растворителя. Диффузия – самопроизвольный процесс, результат беспорядочного движения молекул раствора, который приводит к выравниванию концентрации раствора, усилению беспорядка в системе и возрастанию энтропии.
Сила, обуславливающая осмос, отнесенная к единице поверхности – осмотическое давление. Измеряют осмотическое давление прибором - осмометром. Он состоит из сосуда с трубкой, которая соединяется с манометром. Окошко сосуда закрыто полупроницаемой мембраной. Сосуд с раствором и опускают в растворитель. Растворитель диффундирует через мембрану в раствор, уровень жидкости в трубке осмометра повышается, что создает гидростатическое давление. С увеличением гидростатического давления диффузия замедляется. Гидростатическое давление, установившееся с наступлением равновесия, фиксируется манометром Оно служит мерой осмотического давления.
Я.Г. Вант-Гофф в 1884 г., на основании анализа экспериментальных данных П.Ф. Пфейфера по измерению осмотического давления растворов сахара , получил уравнение:
| росмV = vRT, | (7.13) |
где росм – осмотическое давление, в н/м2;
V – объем раствора, в м3.
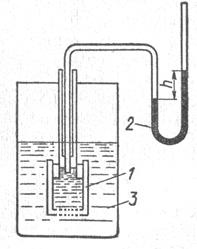
Рис. 7.3.Схема осмометра:
1 – осмометр; 2 – манометр;3 – сосуд с растворителем.
Усмотрев, что между состоянием вещества в растворе и газообразным состоянием имеется качественная и количественная аналогия он сформулировал закон:осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре.
В области малых концентраций растворы подчиняются газовым законам и к ним применимо уравнение Менделеева-Клапейрона, т.е. осмотическое давление пропорционально концентрации растворенного вещества и абсолютной температуре.
Осмотическое давление имеет большое значение для живых организмов, способствуя поступлению воды к клеткам. Осмотическое давление обеспечивает тургор (упругость) клеток.
Растворы с одинаковым осмотическим давлением – изотонические (физиологический раствор – 0,9% NaCl изотоничен плазме крови). Растворы с большим осмотическим давлением – гипертонические, с меньшим – гипотонические. В гипертонических растворах наблюдается сморщивание клеток из-за потери воды (плазмолиз). Гемолиз крови – разрушение клеток крови имеет место при погружении эритроцитов в гипотонический раствор.
Для приготовлении варенья, солений используется добавка большого количества соли или сахара, получающиеся при этом гипертонические растворы обезвоживают гнилостные микроорганизмы.
Все выше изложенное относится к растворам органических веществ в воде.
Дата добавления: 2017-11-21; просмотров: 2309;











