Строение двойного электрического слоя на границе раздела фаз. Электрические свойства коллоидных растворов
На границе раздела фаз между коллоидной частицей и дисперсионной средой возникает двойной электрический слой (ДЭС). Поверхность коллоидной частицы несет ионы определенного знака, которые называют потенциалобразующими (рис. 7.10). К твердой поверхности из жидкой среды притягиваются гидратированные ионы противоположного знака (противоионы).
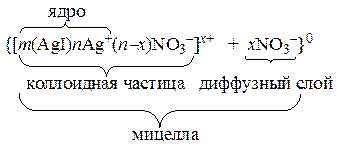
| AgI золь |
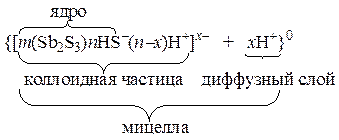
| Sb2S3 золь |
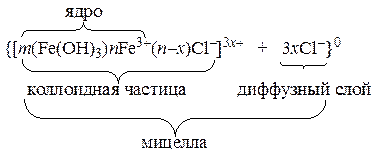
| Fe(OH)3 золь |
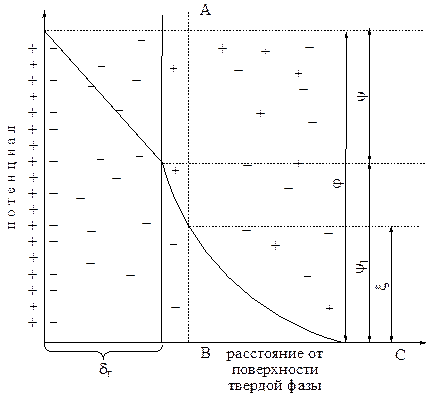
|
Рис. 7.10. Модель строения двойного электрического слоя:
ψ – потенциал адсорбционного слоя, ψ1 – потенциал диффузного слоя;
φ – общий скачок потенциала в ДЭС,ξ – электрокинетический потенциал (дзета-потенциал); δГ – толщина адсорбционного слоя.
Слой противоионов состоит из плотной и диффузной части. Плотная часть – адсорбционный слой, или слой Гельмгольца. Потенциалобразующий слой и противоионы расположены на молекулярном расстоянии друг от друга. Противоионы диффузного слоя способны перемещаться в результате теплового движения, диффузии и взаимного отталкивания в пределах диффузного слоя вглубь жидкости.
Общий скачок потенциала в ДЭС (φ –динамический потенциал) равен сумме скачков потенциала в адсорбционном слое ψ и диффузионном ψ1. Из гидродинамики известно, что плоскость скольжения (линия АВ) движущегося твердого тела в жидкости проходит не по границе адсорбционный слой Гельмгольца – диффузный слой, а на некотором расстоянии от нее.
Скачек потенциала на границе неподвижный – подвижный слой жидкости, называется электрокинетическим, или дзета-потенциалом (ξ-потенциал). Онимеет тот же знак, что и заряд коллоидной частицы. Его величина зависит от концентрации противоионов, их заряда и температуры среды.
Наличие электрических свойств у коллоидных частиц объясняет то, что частицы дисперсной фазы в коллоидном растворе не слипаются. Сохранение коллоидной степени дисперсности обусловлено, прежде всего, наличием одноименного электрического заряда частиц дисперсной фазы, вызывающего их взаимное отталкивание. Заряд частиц обуславливает и их гидратацию. Полярные молекулы воды определенным образом ориентируются относительно заряженных частиц и вступают с ними во взаимодействие. Гидратные оболочки коллоидных частиц также способствуют сохранению дисперсности системы, препятствуя их слипанию.
Электрические свойства коллоидных растворов были исследованы в 1909 году профессором Московского университета Ф.Ф. Рейссом. Он наблюдал воздействие постоянного тока на диспергированную в воде глину. Коллоидные частицы глины перемещались к аноду, а вода – к катоду. Что свидетельствовало о наличии заряда у коллоидных частиц глины. Движение частиц дисперсной фазы к одному из электродов получило название электрофореза, это явление используют в борьбе с топочными дымами и производственной пылью, в медицине, а движение частиц дисперсионной среды – электроосмоса (используют для понижения уровня грунтовых вод).
Дата добавления: 2017-11-21; просмотров: 1429;











