Самопроизвольные поверхностные процессы
Самопроизвольными процессами являются те, что сопровождаются уменьшением свободной энергии Гиббса (ΔG < 0). Поскольку поверхностное натяжение является свободной поверхностной энергией единицы площади поверхности, то:
| G = σ·S. | (7.25) |
Дифференцируя это уравнение получим:
| σ·dS + S·dσ < 0 | (7.26) |
Из неравенства следует, что самопроизвольные процессы на границе раздела фаз связаны с уменьшением площади межфазной поверхности или уменьшением поверхностного натяжения.
Уменьшение площади межфазной границы может происходить при укрупнении твердых частиц дисперсной фазы при их слипании (коагуляция), слиянии капель в эмульсиях или пузырьков газа в пенах (коалесценция), образовании сферических капель жидкости или газа, поскольку шар имеет самую маленькую удельную поверхность. Уменьшение поверхностного натяжения может происходить при 1) перемещении жидкости; 2) нагревании; 3) адгезии (прилипании); 4) адсорбции; 5) образовании двойного электрического слоя.
Адсорбция
Адсорбция – концентрирование (сгущение) веществ на поверхности раздела фаз. Вещество, которое адсорбирует другое вещество, называют адсорбентом. Вещество, находящееся в объеме, которое может быть адсорбировано – адсорбтив. Это же вещество в адсорбированном состоянии – адсорбат. Процесс обратный адсорбции – десорбция. Адсорбция относится к поверхностным процессам и протекает самопроизвольно до состояния равновесия между процессами адсорбции и десорбции, когда DG = 0.
Количественно адсорбция характеризуется избыточной (гиббсовской) адсорбцией (Г) – избыток адсорбата в поверхностном слое по сравнению с концентрацией адсорбтива в объеме фазы, приходящийся на единицу площади поверхности:
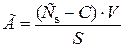 , , 
| (7.27) |
где Сs и С – молярная концентрация адсорбата в поверхностном слое и в объеме фазы, V – объем поверхностного слоя равный 1 см2, поскольку его принято считать двухмерным, S – площадь поверхностного слоя.
7.9.4.1. Адсорбция на границе раздела Ж-Г состоит в концентрации на поверхности раздела растворенного в жидкости вещества.
Исходя из второго закона термодинамики Дж. Гиббс вывел уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:
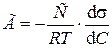 , ,
| (7.28) |
где Г – избыточная адсорбция адсорбата, С – молярная концентрация его в растворе, Т – температура, при которой происходит адсорбция, R – газовая постоянная.
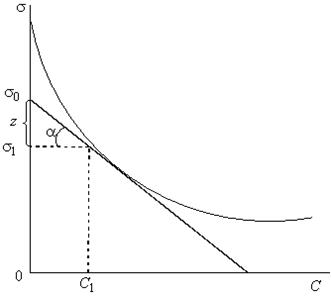
Рис. 7.6.Определение избыточной адсорбции.
Для расчета избыточной адсорбции по уравнению Гиббса надо иметь экспериментально полученную зависимость σ–С. Производная 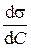 определяется графически как тангенс угла наклона касательной, проведенной к данной точке кривой графика такой зависимости. Используя значения производной, рассчитывают по уравнению Гиббса значения избыточной адсорбции для разных концентраций:
определяется графически как тангенс угла наклона касательной, проведенной к данной точке кривой графика такой зависимости. Используя значения производной, рассчитывают по уравнению Гиббса значения избыточной адсорбции для разных концентраций:
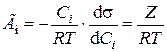 . .
| (7.29) |
По полученным результатам можно построить изотерму адсорбции Г = f(C). По мере увеличения концентрации вещества в растворе наблюдается сначала резкое возрастание адсорбции, затем постепенное замедление при приближении к предельной адсорбции (Г∞). Предельная адсорбция наблюдается, когда поверхность полностью занята адсорбатом. Поскольку адсорбция на однородной поверхности жидкости мономолекулярная, дальнейшее увеличение концентрации адсорбтива не может ничего изменить.
Различные вещества по-разному влияют на поверхностное натяжение растворов. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). В водных растворах поверхностно-активными являются молекулы, имеющие асимметричное строение. Например: карбоновые кислоты имеют неполярный гидрофобный углеводородный радикал и полярную гидрофильную карбоксильную группу (–СООН). Схематически это изображается в виде кружка (полярная группа) и черточки (гидрофобный радикал). Если гидрофобная часть молекулы длинная, то ее изображают ломаной линией (рис. 7.7). У органических веществ, принадлежащих другим классам соединений, к числу гидрофильных групп относятся: –OH, –CHO, –NH2, –SH, –CNS, –SO2H, –CN, –NO и др.
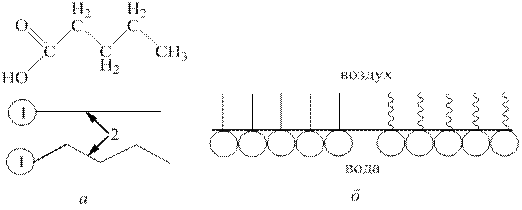
Рис. 7.7. Строение молекулы валериановой кислоты (а), и адсорбционный слой ПАВ на границе раздела вода-воздух (б): 1 – гидрофильная часть, 2 – гидрофобная часть молекулы ПАВ.
В результате адсорбции ПАВ поверхностное натяжение воды (72,75 мДж/м2) снижается: в присутствии 0,24% раствора валериановой кислоты до 42,1 мДж/м2.
Поверхностно-активными по отношению к воде являются вещества, молекулы которых обладают меньшим дипольным моментом (вода – 1,84 D, этанол – 1,70 D). Молекулы этанола взаимодействуют с водой слабее, чем молекулы воды между собой, поэтому они будут уменьшать поверхностное натяжение.
Согласно теории Ленгмюра полярные группы ПАВ втягиваются вглубь фазы (рис.7.7, б), а неполярные углеводородные части выталкиваются в неполярную среду – воздух. В насыщенном адсорбционном слое все углеводородные радикалы принимают вертикальное положение, максимальная адсорбция при этом не зависит от длины «хвоста», а определяется только поперечным сечением молекулы, которая одинакова у членов одного гомологического ряда. Поэтому зная Г∞ можно рассчитать поперечный размер молекулы.
Вещества, повышающие поверхностное натяжение – поверхностно-инактивные (ПИВ). К ним относятся сильные электролиты – соли, кислоты, щелочи. Ионы, образующиеся при диссоциации, взаимодействую с молекулами воды сильнее, чем те между собой, поэтому даже незначительная часть ионов, оставшихся на поверхности, не перешедшая в объем раствора, создавая силовое поле, повышает поверхностное натяжение.
Не влияют на поверхностное натяжение поверхностно-неактивные вещества с большим числом полярных групп, например, сахароза. В таких молекулах имеется баланс полярных и неполярных участков молекулы.
Способность вещества при адсорбции на границе раздела фаз снижать поверхностное натяжение в зависимости от его концентрации в объеме называется поверхностной активностью (g). Она определяется знаком и значением отношения 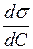 при С → 0:
при С → 0:
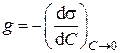 . .
| (7.30) |
Поверхностная активность возрастает с уменьшением полярности вещества. Для предельных жирных кислот установлено, что их поверхностная активность возрастает в 3-3,5 раза при удлинении углеводородной цепи на одно звено (–СH2–) – правило Дюкло-Траубе.
7.9.4.2. Адсорбция на поверхности твердых тел. На поверхности твердых тел при контакте с газом в условиях равновесия поверхностная концентрация газа выше, чем в объеме газа.
Поверхность твердого тела неоднородна. Адсорбция происходит на активных центрах поверхности. Она обратима, равновесие адсорбция – десорбция устанавливается быстро.
Адсорбент может иметь поры, наличие которых приводит к капиллярной конденсации. Помимо адсорбции может наблюдаться абсорбция, когда газ поглощается всем объемом адсорбента (водород платиновыми металлами).
Адсорбция газов может быть физической и химической. Хемосорбция является необратимой, т.к. молекулы адсорбата образуют с адсорбентом химические соединения. Чаще имеет место сочетание действия адсорбционных сил разной природы.
Для аналитического описания адсорбции газа на твердой поверхности Фрейндлих вывел эмпирическое уравнение :
| A = b·p1/n, | (7.31) |
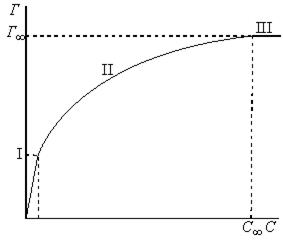
где b и 1/n – константы, зависящие от природы газа и температуры, и не зависящие от равновесного давления газа в системе. Уравнение Фрейндлиха – уравнение параболы, описывающее только участок II изотермы (рис. 7.8). Для линейного участка I константа 1/n должна быть равной единице:
| A = b·p. | (7.32) |
Данная зависимость является выражением закона Генри: величина адсорбции при малых давлениях прямо пропорциональна давлению.
Для описания участка III 1/n должна быть равной нулю, тогда A = b.
| 
|
| Рис. 7.8. Изотерма адсорбции Ленгмюра. | Рис.7.9.Изотерма полимолекулярной адсорбции. |
Строгая теория мономолекулярной адсорбции создана И.Ленгмюром. Теория Лэнгмюра описывает изотерму мономолекулярной адсорбции на всех ее участках. В основе теории лежат следующие допущения:
1. Адсорбция имеет место на энергетически равноценных активных центрах.
2. На одном центре адсорбируется одна молекула адсорбтива.
3. Молекулы адсорбата не взаимодействуют между собой.
Скорость адсорбции (Vадс) зависит от концентрации адсорбтива (С) и площади незанятой поверхности (1–n):
Vадс = kадс×C×(1 – n).
Скорость десорбции зависит от площади занятой поверхности (n):
Vдес = kдес×n.
В состоянии равновесия:
kадс×C×(1 – n) = kдес×n
или
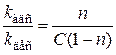 ,
,
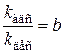 ;
;
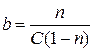 ,
,
где b –константа равновесия.
Выразим из полученного уравнения n:
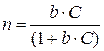 .
.
При n = 1 наблюдается максимальная адсорбция – Г¥. Число молекул в ненасыщенном n и насыщенном n¥ адсорбционных слоях можно выразить через адсорбцию:
n = Г·NA,
n¥ = Г¥·NA.
Подставивзначения n и n¥, получим уравнение изотермы Ленгмюра:
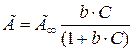 . .
| (7.33) |
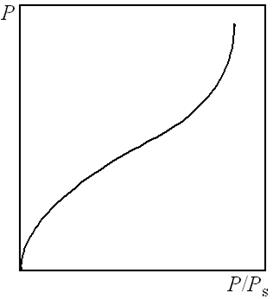
Однако, наряду с изотермами, описываемыми уравнениями Ленгмюра, получены S-образные изотермы (рис. 7.9), на которых нет участка насыщения адсорбента адсорбатом, а имеется участок крутого подъема, указывающего на образование следующих слоев на первом слое адсорбированного вещества.
7.9.4.3. Поляни предложил модель, позволившую описать адсорбцию на пористых адсорбентах и качественно объяснить характер S-образной изотермы полимолекулярной адсорбции. Эта модель потенциальной теории адсорбции констатирует существование силового поля вблизи поверхности адсорбента, которое убывает с удалением от поверхности. При приближении к поверхности давление адсорбтива возрастает и вблизи поверхности достигает значения, при котором адсорбтив конденсируется.
Дальнейшим развитием теории полимолекулярной адсорбции стала теория БЭТ (Брунауэра, Эммета, Теллера). Согласно этой теории адсорбированная в первом слое на активном центре поверхности молекула сама становится центром для молекул, образующих второй слой и т.д. Образование последующих слоев рассматривается как конденсация. Уравнение БЭТ описывает всю S-образную изотерму адсорбции. Теория БЭТ позволила определять удельную поверхность адсорбента.
7.9.4.4. Адсорбция на границе раздела Т-Ж – самопроизвольный процесс концентрирования растворенного вещества у твердой поверхности.
Различают молекулярную адсорбцию (адсорбция молекул неэлектролитов или слабых электролитов) и ионную адсорбцию сильных электролитов.
Особенностью молекулярной адсорбции является конкуренция, поскольку молекулы растворенного вещества должны вытеснить молекулы воды, занимающие активные центры на поверхности твердого вещества.
Количественно адсорбцию на твердом веществе характеризуют как:
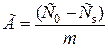 , моль/г , моль/г
| (7.34) |
где Г – количество вещества, приходящийся на 1 г адсорбента; m – масса адсорбента, г; V – объем раствора, из которого идет адсорбция, л; С0 – молярная концентрация адсорбтива до контакта с адсорбентом; Сs – молярная концентрация адсорбтива после опыта.
Адсорбция может описываться изотермами различного вида, поскольку на форму получаемых изотерм может влиять природа растворителя, адсорбента, адсорбтива, взаимодействие молекул адсорбата, изменение их конформации при насыщении адсорбционного слоя и др. здесь рассмотрены наиболее простые виды изотерм.
Из растворов сильных электролитов адсорбируются ионы. Ионы адсорбируются тем лучше, чем более полярен адсорбент. На положительно заряженных активных центров адсорбента адсорбируются анионы, а на отрицательных – катионы. На полярной поверхности лучше адсорбируются ионы, обладающие большей поляризуемостью, следовательно, чем больше радиус ионов, тем лучше их адсорбция, поскольку с увеличением радиуса поляризуемость растает. Напряженность электрического поля иона с увеличением радиуса падает, поэтому уменьшается степень гидратации иона, что также способствует адсорбции. По способности адсорбироваться ионы располагают в лиотропные ряды:
Li+ < Na+ < K+ < Rb+ < Cs+,
Mg2+ < Ca2+ < Sr2+ <Ba2+,
Cl– < Br– < NO3– < I– < NCS–.
Заряд иона также увеличивает его способность притягиваться к заряженной поверхности:
K+ << Ca2+ << Al3+.
Адсорбцию ионов на кристаллической поверхности принято рассматривать как кристаллизацию – достройку кристаллической решетки ионами из раствора, в соответствии с правилом Панета – Фаянса: На кристаллической поверхности адсорбируются те ионы, которые способны достраивать кристаллическую решетку и дают трудно растворимые соединения с ионами кристалла.
Адсорбция ионов твердой фазой коллоидного раствора ведет к образованию двойного электрического слоя на поверхности, что является одним из способов, который определяет электрические свойства частиц.
Дата добавления: 2017-11-21; просмотров: 1909;











