Химические свойства
- Сильные кислоты в воде хорошо диссоциируют:
а) 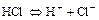 ,
,
б) 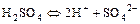
или 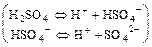
Индикаторы в кислой среде приобретают соответствующую окраску:
фенолфталеин – бесцветный;
лакмус – красный;
метилоранж – розовый.
- Кислота + активный металл = соль +
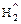 (кроме
(кроме 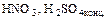 )
)
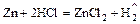 .
.
- Кислота + основание = соль + вода
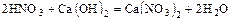 .
.
- Кислота + о. оксид = соль + вода
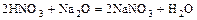 .
.
- Сильная кислота + соль = более слабая кислота + новая соль
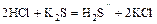 .
.
- Разложение неустойчивых кислот:
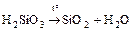 .
.
- В зависимости от окислительно-восстановительных свойств кислоты по-разному реагируют с неметаллами (
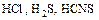 - восстановители;
- восстановители; 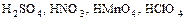 - окислители):
- окислители):
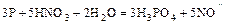 ,
,
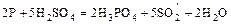 .
.
Получение
- из кислотных оксидов (реакции идут по-разному)
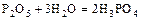 .
.
- соль + сильная кислота = новая соль + более слабая кислота
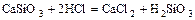 .
.
-
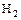 + отдельные неметаллы = газ, раствор которого в воде будет кислотой
+ отдельные неметаллы = газ, раствор которого в воде будет кислотой
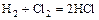 ,
,
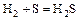 .
.
СОЛИ
Классификация:
а) средние – состоят из катиона металла или аммония и кислотного остатка 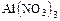 ,
, 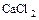 ;
;
б) кислые – получаются при неполном замещении атомов водорода на металл 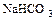 ,
, 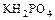 ;
;
в) основные – в катионе при металле от соответствующего основания сохраняется часть групп – ОН: 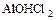 ,
, 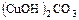 ;
;
г) двойные – например квасцы 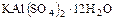 ,
, 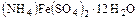
д) комплексные - 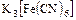 ,
, 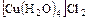 .
.
Дата добавления: 2017-10-04; просмотров: 1169;











