Метод молекулярных орбиталей (МО)
Развили этот метод Р. Малликен и Ф. Гунд, он дополняет и углубляет метод валентных связей. Квантово-механические закономерности, установленные для атомов, распространяются на молекулу:
1.При образовании молекул имеет место не механическое перекрывание орбиталей, а валентные электроны с атомных орбиталей(АО) переходят на молекулярные орбитали (МО), новые по энергии и форме.
2.Из двух исходных атомных получают две молекулярные орбитали, одна из которых энергетически более выгодна и называется “связывающей”, а другая не выгодна по сравнению с атомной и называется “разрыхляющей”.
3.Устойчивость молекулы оценивается по величине порядка связи (ПС):
ПС = 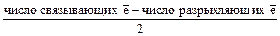
Если ПС =1(и больше), то молекула устойчива
ПС = 0,5 – молекула неустойчива
ПС = 0 - молекулы не существует
4.Для молекул, образованных неметаллами, значение рассчитанной величины ПС совпадает с величиной кратности связи, определенной по методу валентных связей. Однако метод МО позволяет доказать существование молекул Li2 , C2, заряженных частиц 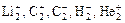 и др.
и др.
5.Метод объясняет наличие магнитных свойств у многих молекул (например жидкий кислород – парамагнетик):
а)если на всех молекулярных орбиталях находятся только спаренные электроны, то вещество – диамагнетик;
б)если на молекулярных орбиталях имеется хотя бы один неспаренный электрон (неважно, на связывающих или разрыхляющих) – то вещество парамагнетик.
Вопросы для закрепления материала:
1.Какой тип связей существует в молекулах HNO3? KNO2?
2.Какая из указанных молекул имеет наиболее ковалентный характер связи – а)LiCI? б) NaH? в) KCI?
Дата добавления: 2017-10-04; просмотров: 1251;











