V. Водородная связь
Очень слабая, но важна для биологии. Образуется между атомами Н одной молекулы и электроотрицательными атомами другой молекулы.
Природа сил:
1) электростатическая;
2) донорно-акцепторная.
Примеры:
1) В молекуле HF ковалентная полярная связь, молекулу можно представить в виде диполя
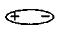
Так как молекулы сильно поляризованы, между ними возникает притяжение прежде всего за счет электростатических сил. И в отличие от HCl, единичных молекул HF нет, а известны «ассоциаты» Н2 F2, …, H6 F 6
Это сказывается на химических свойствах плавиковой кислоты: в отличие от других кислот типа НГал, плавиковая кислота является слабой (диссоциация затруднена из-за межмолекулярного взаимодействия):
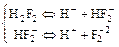
2) Рассмотрим молекулу Н2О. Сравним соединения Н2О и H2S (на основании положения кислорода и серы в Периодической системе соединения Н2О и H2S должны быть похожи). 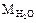 = 18 г/моль,
= 18 г/моль, 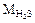 = 34 г/моль, однако при обычных условиях Н2О - жидкость, a H2S - газ. Почему так, а не наоборот? По-видимому,
= 34 г/моль, однако при обычных условиях Н2О - жидкость, a H2S - газ. Почему так, а не наоборот? По-видимому, 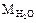 на самом деле значительно больше 18 г/моль. Это возможно только в том случае, если при обычных условиях Н2О существует не в виде единичных молекул, а объединяется в ассоциаты. Сравним кислород и серу: кислород более электроотрицателен, чем сера. Значит связи Н-О более полярны, чем Н-S и между молекулами Н2О легко образуются водородные связи:
на самом деле значительно больше 18 г/моль. Это возможно только в том случае, если при обычных условиях Н2О существует не в виде единичных молекул, а объединяется в ассоциаты. Сравним кислород и серу: кислород более электроотрицателен, чем сера. Значит связи Н-О более полярны, чем Н-S и между молекулами Н2О легко образуются водородные связи:
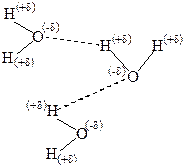
Установили, что единичные молекулы Н2О встречаются только при высокой температуре (в перегретом паре). А в жидком состоянии существуют ассоциаты (Н2О)8, (Н2О)6, (Н2О)4 и др.
Также установлено, что несмотря на многообразие рисунков у снежинок, они изначально кристаллизуются в форме тетраэдра: одна молекула воды окружена четырьмя другими за счет образования водородных связей.
Дата добавления: 2017-10-04; просмотров: 2260;











