Физико-химические свойства растворов неэлектролитов
Растворами называют гомогенные (однородные) системы, состоящие как минимум из двух компонентов. Один из компонентов считается растворителем, остальные - растворенными веществами. В качестве растворителя выбирается тот компонент, который находится в том же агрегатном состоянии, что и раствор. Если под этот критерий подходит несколько компонентов, то растворителем считается то вещество, которого больше. Исключение составляет вода, которая обычно считается растворителем, даже тогда, когда ее меньше.
В зависимости от агрегатного состояния выделяют газообразные, жидкие и твердые растворы. Последние делятся на растворы газов, жидкостей и твердых веществ.
Одной из важнейших характеристик раствора является концентрация, отражающая количественное соотношение между его компонентами. Выделяют несколько способов выражения концентрации, из которых важнейшими являются следующие:
1. Массовая доля (w) - отношение массы растворенного вещества (m1) к массе раствора (m).
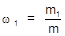
Выражается массовая доля в процентах либо в долях единицы.
2. Объемная доля (j) - отношение объема растворенного вещества к сумме объемов всех компонентов раствора.
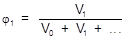
3. Мольная доля (a) - отношение количества данного компонента к суммарному количеству всех компонентов раствора.
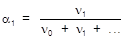
4. Молярность (C, моль/л, М) - отношение количества растворенного вещества к объему раствора.
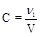
При расчете молярности растворов часто пользуются следующими формулами:
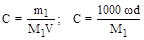 ,
,
где d- плотность раствора.
5. Нормальность (N, моль/л, н.) - отношение количества эквивалента растворенного вещества к объему раствора.
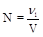
6. Моляльность (Сm, моль/кг) - отношение количества растворенного вещества к массе растворителя.
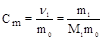
где m0 - масса растворителя (кг).
7. Титр (Т, г/мл) - отношение массы растворенного вещества к объему раствора.
8. Средняя молекулярная масса (Мср., г/моль) - средневзвешенная молекулярная масса смеси газообразных веществ.
Мср. = 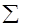 jiMi
jiMi
Любой раствор представляет собой сложную многокомпонентную систему, в которой частицы растворенного вещества равномерно распределены между частицами растворителя и взаимодействуют с ними, образуя непрочные аддукты (продукты присоединения) - сольваты (для водных растворов гидраты).
Термодинамическая устойчивость раствора обусловлена двумя причинами:
· Образование сольватов идет с выделением тепла и приводит к понижению энергии системы.
· Равномерное распределение частиц растворенного вещества между частицами растворителя сопровождается увеличением энтропии.
Вследствие этого образование раствора приводит к понижению изобарно-изотермического потенциала системы (свободной энергии Гиббса).
Строение жидкого раствора в общем виде можно представить следующей схемой:
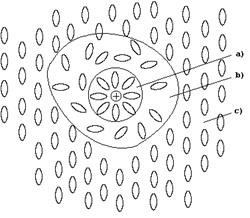
a) зона сольватированной частицы растворенного вещества;
b) зона деструктурированного растворителя;
c) зона структурированного растворителя.
Образование сольватированной частицы сопровождается выделением энергии (теплоты сольватации) и уменьшением энтропии. Образование зоны деструктурированного растворителя требует затраты энергии, также как и процесс разрушения структуры растворяемого вещества. Одновременно происходит увеличение энтропии за счет разрушения упорядоченной структуры растворителя и растворенного вещества. Поскольку процесс разрушения структуры растворителя энергетически менее емкий, чем процесс разрушения растворяемого вещества, теплоту растворения обычно представляют как разность теплоты сольватации (DНсольв) и энергии взаимодействия частиц растворяемого вещества (Е):
DНраств = DНсольв - Е
В зависимости от доминирующей величины процесс растворения может быть как экзотермическим (например, для H2SO4), так и эндотермическим (NH4NO3).
По способности к взаимной растворимости пары веществ можно разделить на две группы: вещества с неограниченной растворимостью, например, спирт и вода, и вещества с ограниченной растворимостью, например, вода и диэтиловый эфир. Способность последней группы веществ к образованию растворов количественно характеризуется растворимостью. Растворимость – это способность вещества растворяться в данном растворителе, количественной мерой которой является концентрация насыщенного раствора. Насыщенным называется раствор, находящийся в динамическом равновесии с растворяемым веществом. Обычно растворимость выражается коэффициентом растворимости (S) - массой растворенного вещества (г) в 100 г растворителя.
Поскольку растворимость определяется в равновесной системе, для оценки влияния на нее различных факторов можно воспользоваться принципом Ле Шателье. Согласно данному принципу можно ожидать, что растворимость газов будет сильно увеличиваться при увеличении давления, так как данный процесс сопровождается сильным изменением объема системы. Количественно эта закономерность передается законом Генри: при постоянной температуре растворимость газа прямо пропорциональна его парциальному давлению. В то же время, можно ожидать, что растворимость жидкостей и твердых веществ будет незначительно зависеть от давления. Для веществ, растворяющихся с поглощением тепла, следует ожидать увеличения растворимости с увеличением температуры, в то время как для веществ, растворяющихся с выделением тепла, зависимость растворимости от температуры носит более сложный характер.
Основным фактором, влияющим на растворимость, является природа растворенного вещества и растворителя. К сожалению, до настоящего времени нет единой теории, позволяющей теоретически предсказать влияние природы веществ на растворимость. Более или менее удачно работает правило "подобное растворяется в подобном". Согласно этому правилу вещества полярные лучше растворяются в полярных растворителях, а вещества неполярные - в неполярных растворителях.
Физико-химические свойства разбавленных растворов неэлектролитов в основном определяются растворителем и зависят от концентрации растворенного вещества, но не зависят от его природы. Такие свойства называются коллигативными. К коллигативным свойствам растворов относятся осмотическое давление, давление насыщенного пара над раствором, температура кипения и кристаллизации (замерзания).
Осмосом называется односторонняя диффузия растворителя через полупроницаемую мембрану. Движущей силой осмоса является градиент (разность) концентраций растворителя по обе стороны мембраны, вызывающая его перемещение в более концентрированный раствор. Дополнительное давление, которое нужно приложить к раствору, для того, чтобы предотвратить поступление в него растворителя, называется осмотическим. Измеряют осмотическое давление в осмометрах, в которых осмотическое давление равно гидростатическому давлению столба жидкости, образовавшегося при проникновении растворителя в раствор.
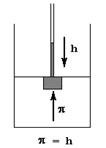
Теоретически рассчитать осмотическое давление можно по закону Вант-Гоффа: осмотическое давление раствора равно давлению, которое оказывало бы растворенное вещество, находящееся в газообразном состоянии и занимая объем раствора. Если применить к раствору уравнение Менделеева-Клапейрона, pV = nRT,то можно получить следующее выражение:
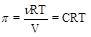 ,
,
в котором p - осмотическое давление растворителя, а С - концентрация растворенного вещества в моль/м3. Для того чтобы выразить концентрацию в более привычной размерности моль/л, необходимо ввести коэффициент пересчета:
p = 1000CRT
Образование раствора приводит к понижению концентрации растворителя. Вследствие этого давление насыщенного пара над раствором ниже, чем над чистым растворителем. Насыщенным называется пар, находящийся в равновесии с жидкостью. Количественно понижение давления насыщенного пара при образовании раствора передается законом Рауля (1887 г.): относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
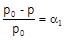
С другой стороны, давление насыщенного пара над раствором нелетучего вещества прямо пропорционально мольной доле растворителя: p = aоpo.
Понижение давления насыщенного пара над раствором приводит к двум важным следствиям: раствор имеет более высокую температуру кипения и более низкую температуру замерзания по сравнению с чистым растворителем. Это можно увидеть, рассмотрев диаграмму состояния воды, на которой представлена зависимость давления насыщенного пара от температуры.
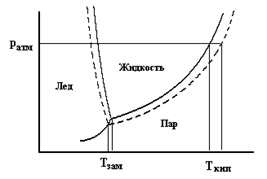
Из рисунка видно, что понижение давления насыщенного пара над раствором приводит к повышению температуры его кипения, поскольку жидкость закипает тогда, когда давление ее пара сравнивается с внешним давлением. Кроме этого, понижение давления насыщенного пара смещает в область более низких температур так называемую тройную точку воды, в которой находятся в равновесии три фазы: лед, жидкость и пар. Это свидетельствует о снижении температуры замерзания (кристаллизации) раствора. При этом как понижение температуры замерзания, так и повышение температуры кипения раствора прямо пропорциональны моляльной концентрации растворенного вещества:
Dtзам = KCm,
где К - криоскопическая постоянная растворителя, имеющая физический смысл депрессии (понижения) температуры замерзания для одномоляльного раствора. Для воды К равна 1,86; для бензола К = 5,17.
Dtкип = ЕСm,
где Е - эбуллиоскопическая постоянная растворителя, имеющая физический смысл повышения температуры кипения для одномоляльного раствора. Для воды Е равна 0,52; для бензола Е = 2,6.
На измерении повышения температуры кипения раствора основан эбуллиоскопический метод определения молярной массы растворенного вещества. Для этого готовят раствор, содержащий m г растворенного вещества в m0 г растворителя, и измеряют повышение температуры его кипения по сравнению с чистым растворителем. Затем рассчитывают молярную массу растворенного вещества по следующим формулам:
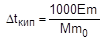 ;
; 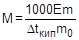
Аналогично можно рассчитать молярную массу растворенного вещества криоскопическим методом, измерив депрессию температуры замерзания раствора:
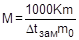
Литература: [1] с. 205 - 222; [2] с. 229 - 253
Дата добавления: 2017-10-04; просмотров: 2640;











